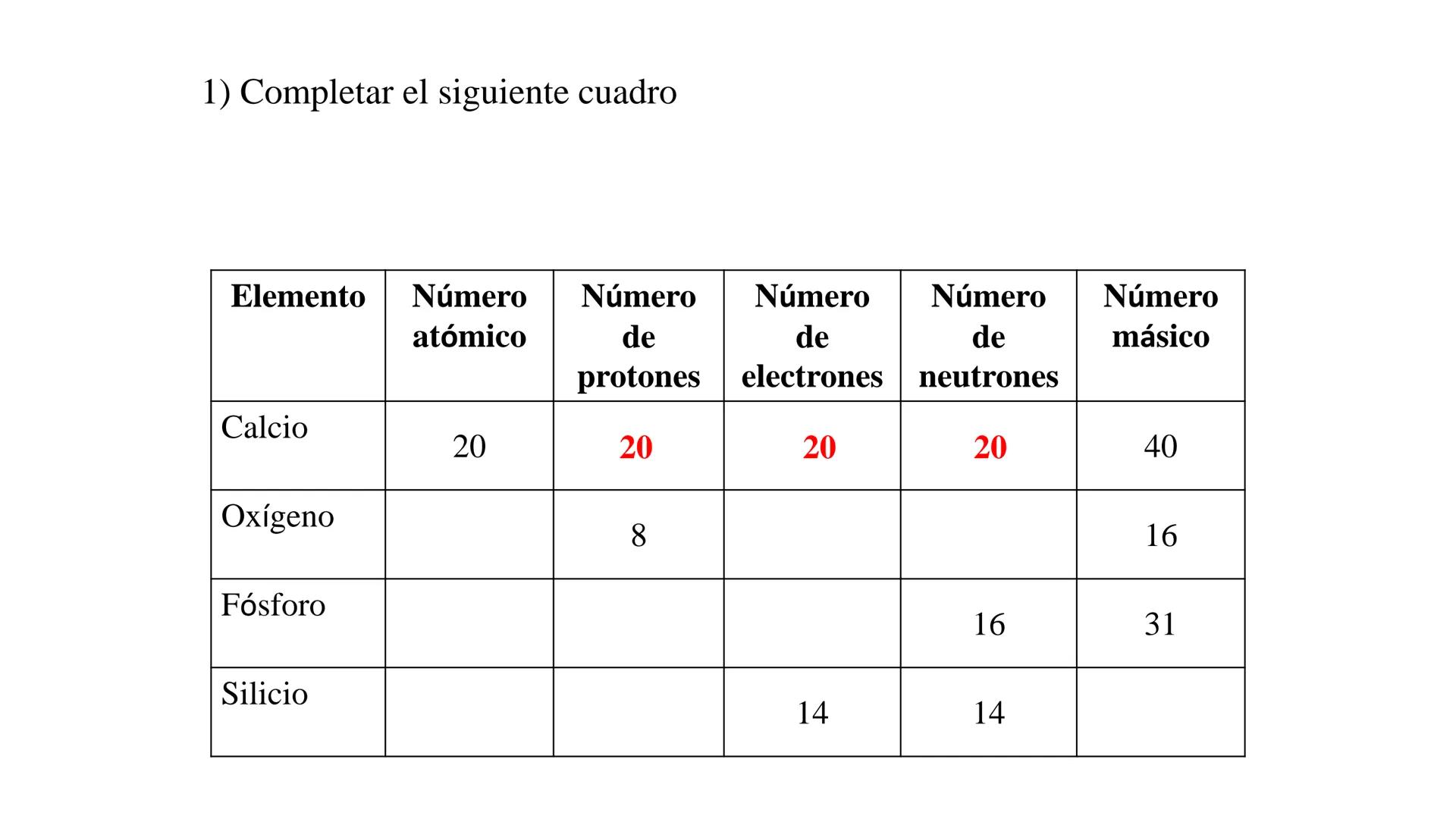
Solución del Ejercicio
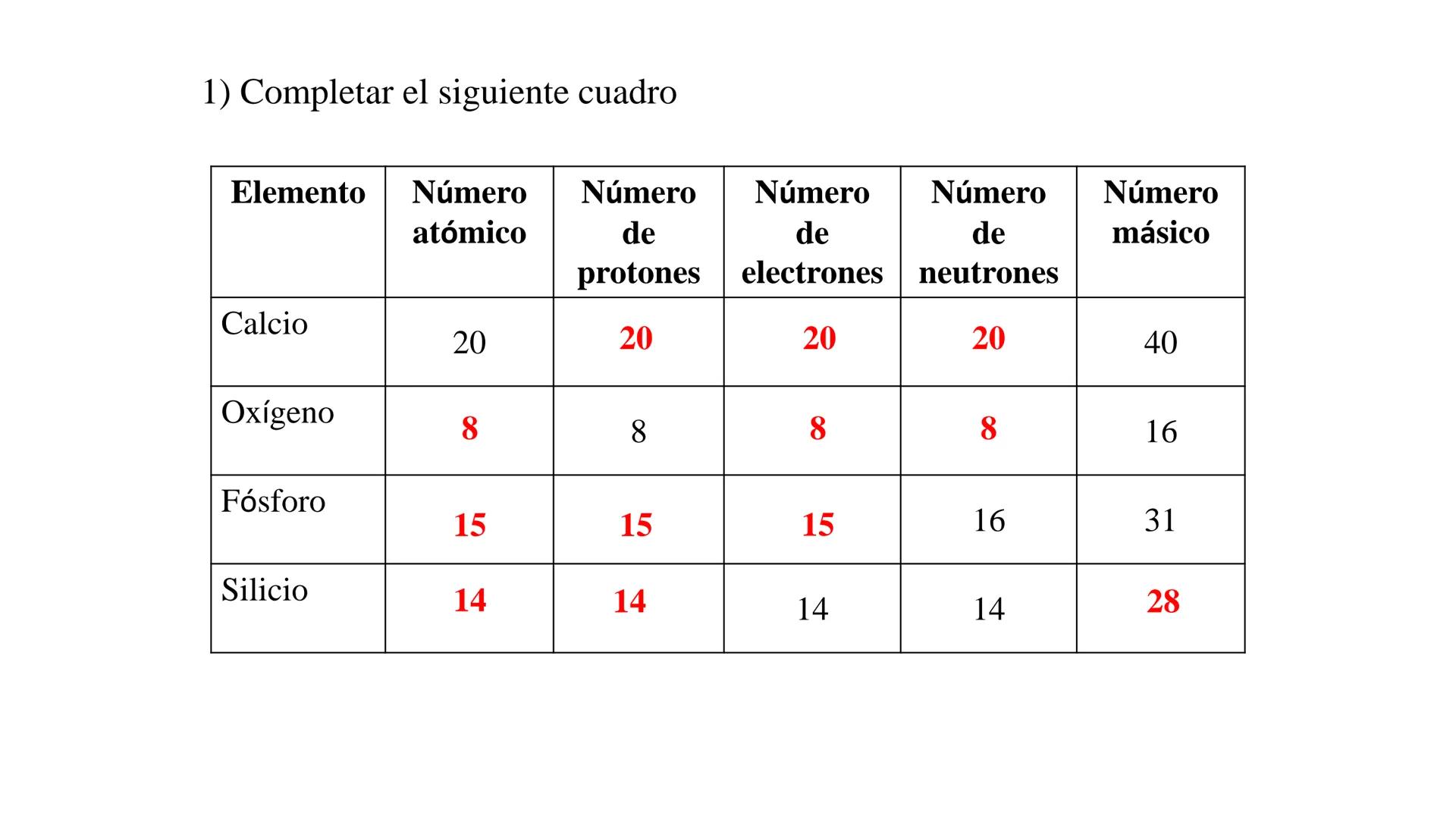
¡Genial! Así es como se completa correctamente la tabla:
| Elemento | Número atómico | Protones | Electrones | Neutrones | Número másico |
|---|
| Calcio | 20 | 20 | 20 | 20 | 40 |
| Oxígeno | 8 | 8 | 8 | 8 | 16 |
| Fósforo | 15 | 15 | 15 | 16 | 31 |
| Silicio | 14 | 14 | 14 | 14 | 28 |
Para el oxígeno, como tiene 8 protones, su número atómico es 8. Con un número másico de 16, tiene 8 neutrones (16 - 8).
Para el fósforo, con 16 neutrones y número másico 31, calculamos que tiene 15 protones (31 - 16), lo que da un número atómico de 15.
Para el silicio, con 14 protones y 14 neutrones, su número másico es 28 (14 + 14).
✅ Verificación: Siempre asegúrate que en un átomo neutro el número de protones y electrones sea idéntico, y que el número másico sea igual a la suma de protones y neutrones.