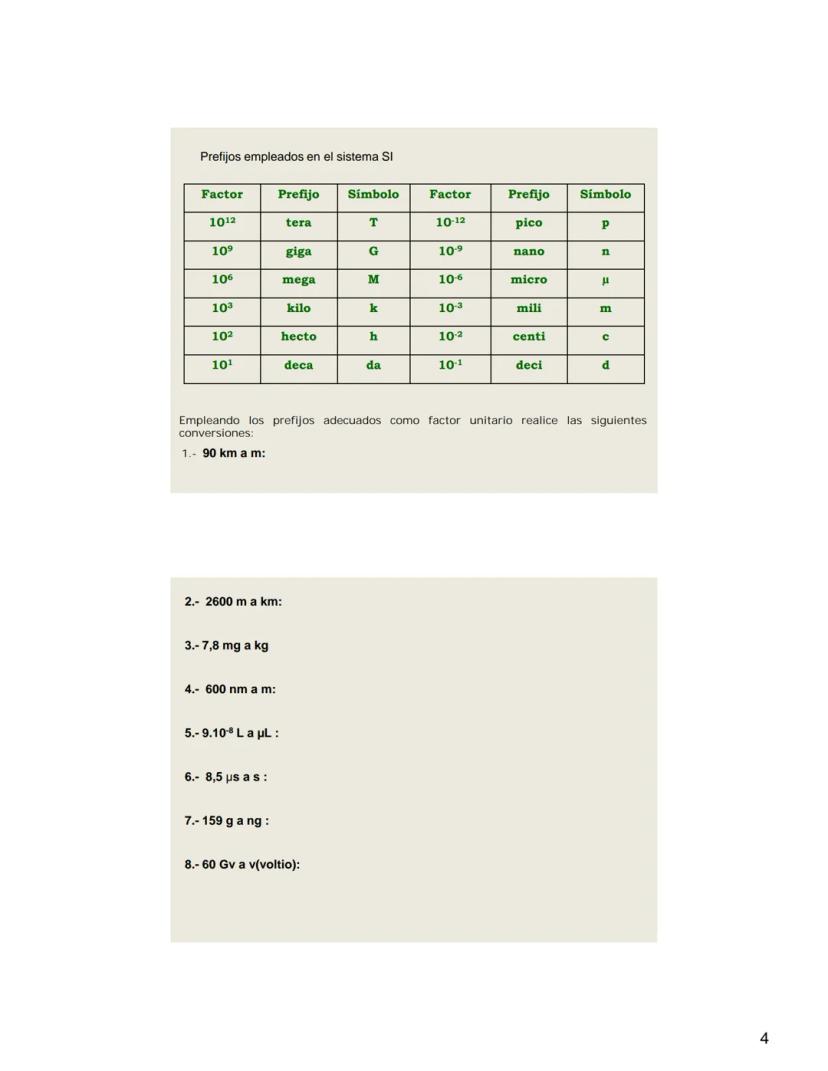
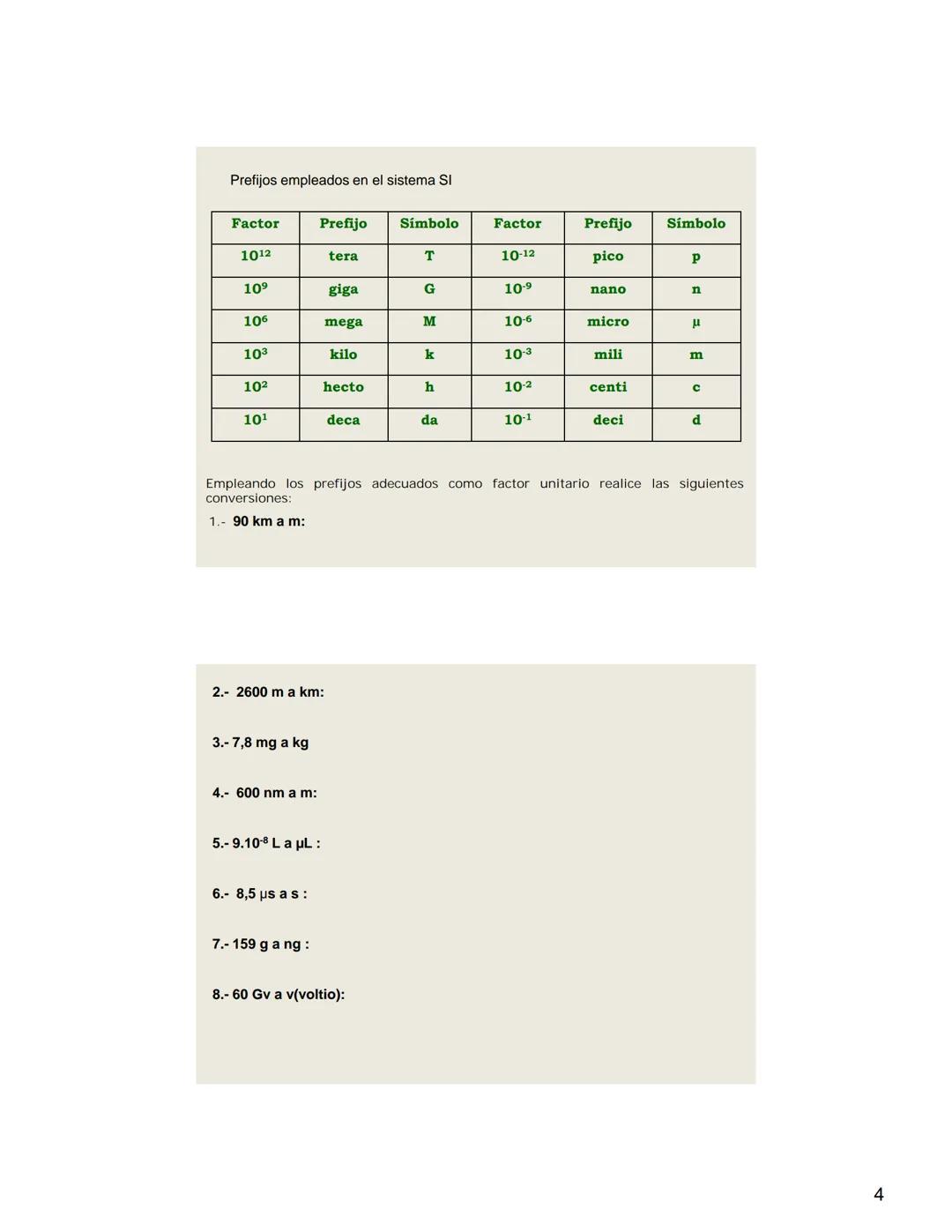
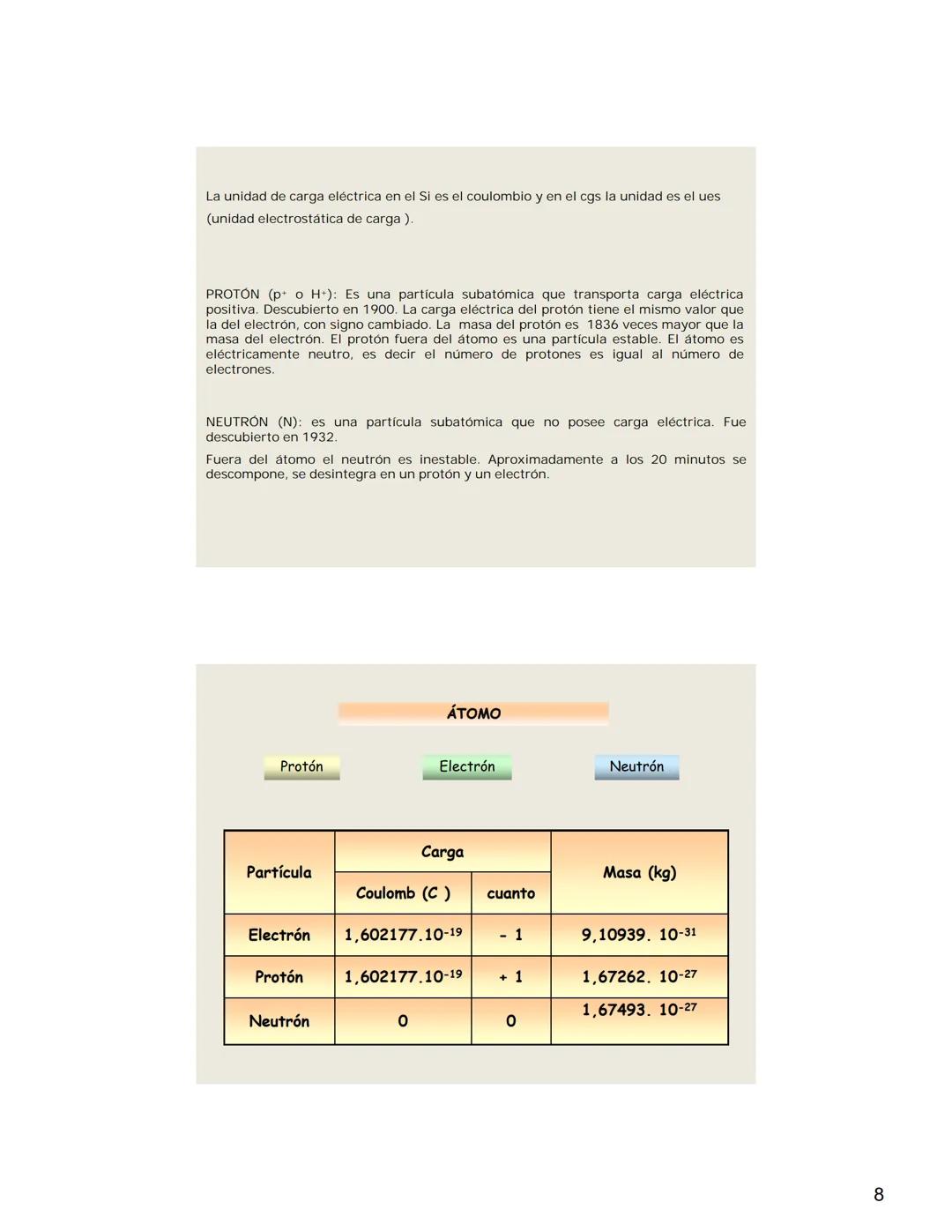
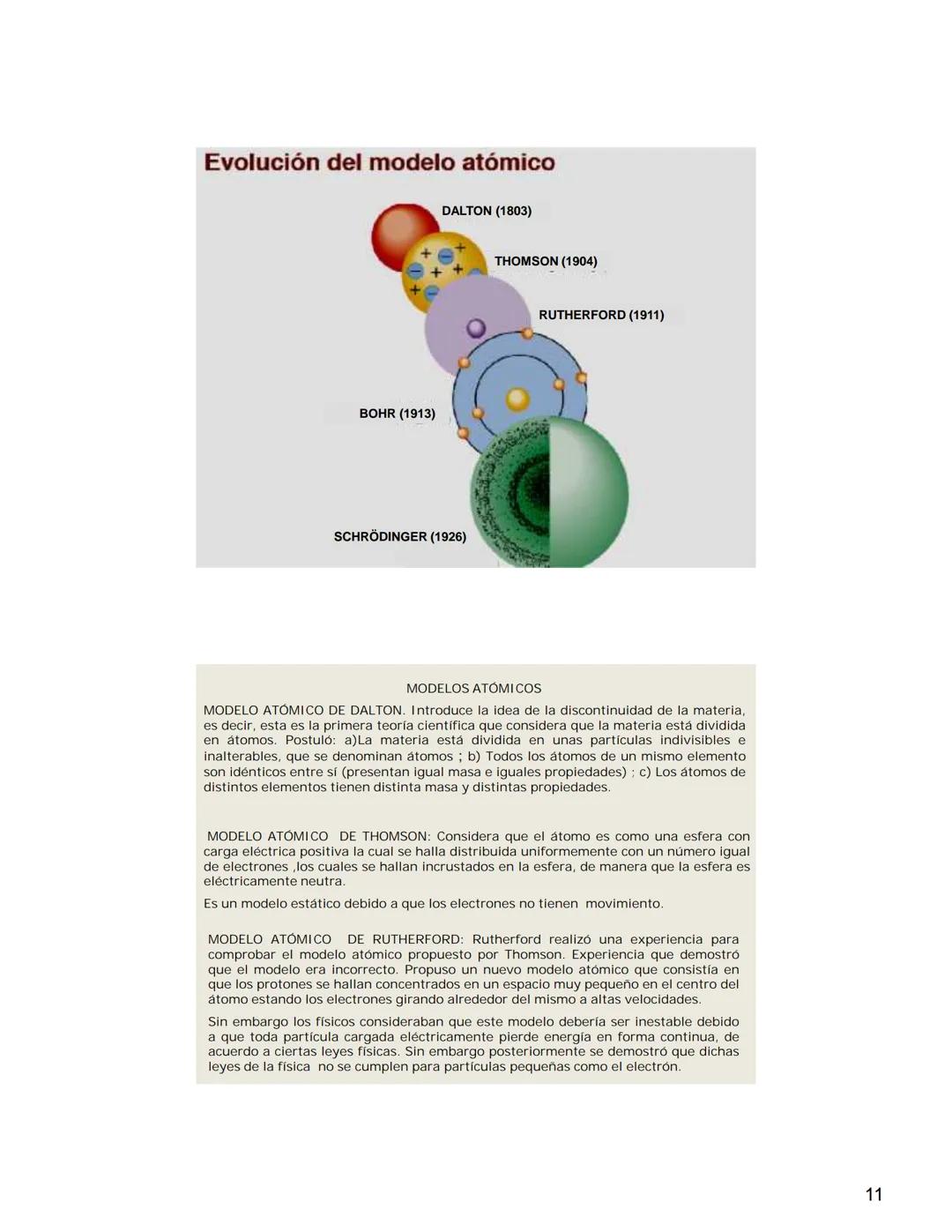
Prefijos del Sistema Internacional
Los prefijos del SI son fundamentales para expresar cantidades muy grandes o muy pequeñas de manera conveniente. En lugar de escribir 0,000000001 metros, simplemente decimos 1 nanómetro (1 nm).
Los prefijos más utilizados abarcan desde el tera (10¹²) hasta el pico (10⁻¹²), permitiendo representar un amplio rango de magnitudes. Por ejemplo, cuando hablamos de un gigabyte (GB), nos referimos a 10⁹ bytes, y cuando mencionamos un milisegundo (ms), hablamos de 10⁻³ segundos.
Para realizar conversiones entre unidades, usamos los prefijos como factores unitarios. Por ejemplo, para convertir kilómetros a metros multiplicamos por 1.000, ya que el prefijo "kilo" representa 10³. Estas conversiones son esenciales en la resolución de problemas químicos.
Las unidades derivadas se forman combinando unidades básicas. Por ejemplo, la velocidad m/s combina longitud y tiempo, mientras que la aceleración m/s2 combina velocidad y tiempo. Esto permite expresar magnitudes físicas complejas de forma coherente.
💡 Truco para recordar: Para convertir unidades con prefijos, piensa en "escalones". Cada prefijo representa un escalón de factor 10. Si vas de mili a micro, bajas un escalón (÷10); si vas de kilo a mega, subes un escalón (×10).