Procesos Osmóticos
La ósmosis es el movimiento de moléculas de solvente (generalmente agua) a través de una membrana semipermeable desde una solución menos concentrada hacia una más concentrada. Este proceso es fundamental en sistemas biológicos.
Cuando dos soluciones con diferente concentración están separadas por una membrana semipermeable:
- El agua se moverá desde la solución hipotónica (menor concentración de solutos)
- Hacia la solución hipertónica (mayor concentración de solutos)
- Hasta alcanzar un equilibrio, llegando a soluciones isotónicas (igual concentración)
La presión que ejerce el solvente al moverse se denomina presión osmótica.
Ósmosis en seres vivos:
Este proceso es crucial para las células, que necesitan mantener un equilibrio osmótico para funcionar correctamente. Por ejemplo, cuando las células vegetales están en un medio hipotónico, absorben agua y se mantienen turgentes.
Ósmosis inversa:
Es el proceso contrario a la ósmosis natural. Mediante la aplicación de presión, se fuerza al solvente a moverse desde la solución más concentrada hacia la menos concentrada.
🌊 La ósmosis inversa se utiliza en la desalinización del agua de mar para obtener agua potable, un proceso cada vez más importante ante la escasez de agua dulce.
La ósmosis inversa tiene múltiples aplicaciones industriales, como tratamiento de aguas residuales, potabilización, y en la industria alimentaria para concentrar zumos, lácteos y otros productos.
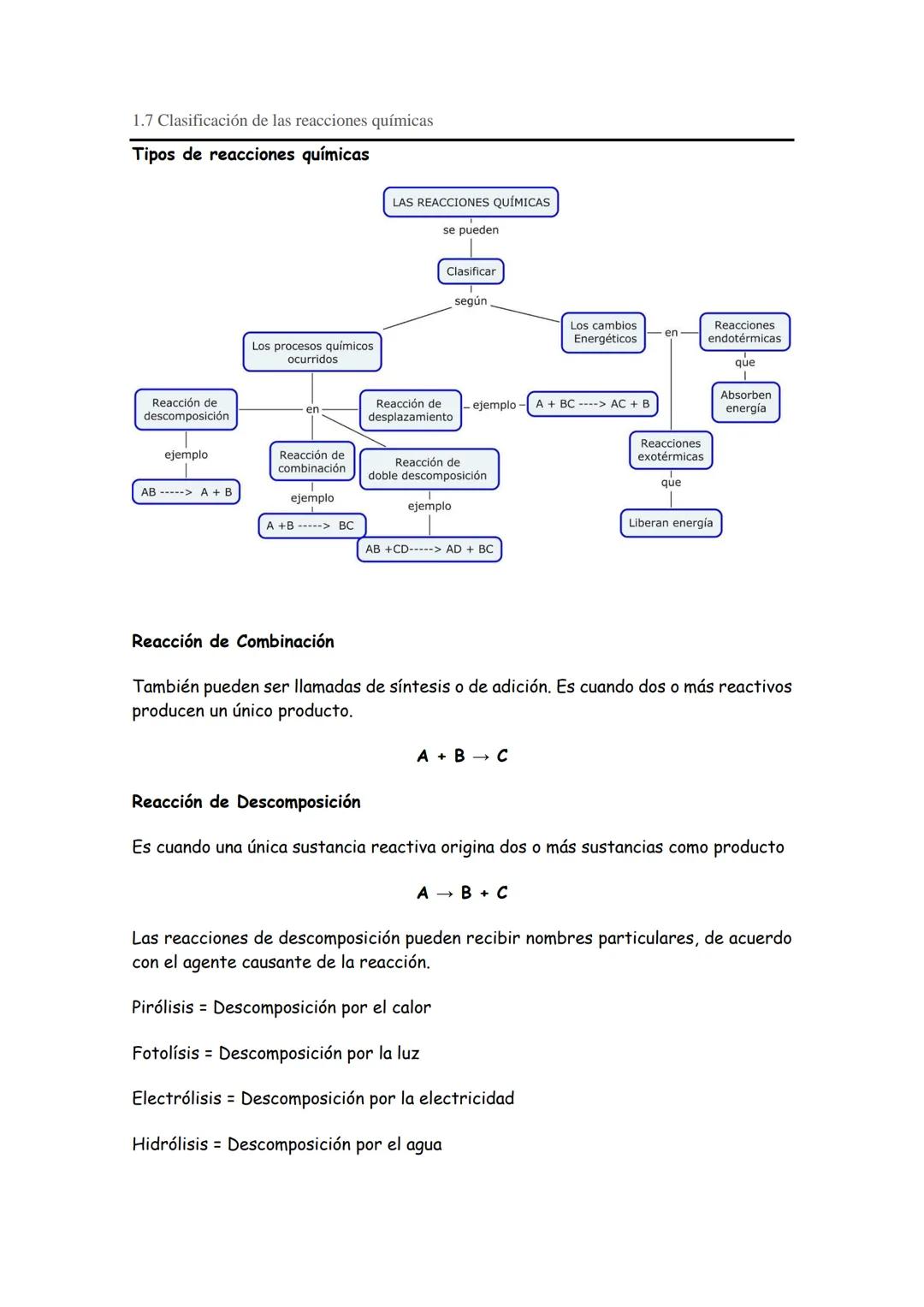
La combustión es otro proceso importante, definido como una reacción de oxidación exotérmica donde un combustible reacciona con oxígeno liberando energía en forma de calor y luz.