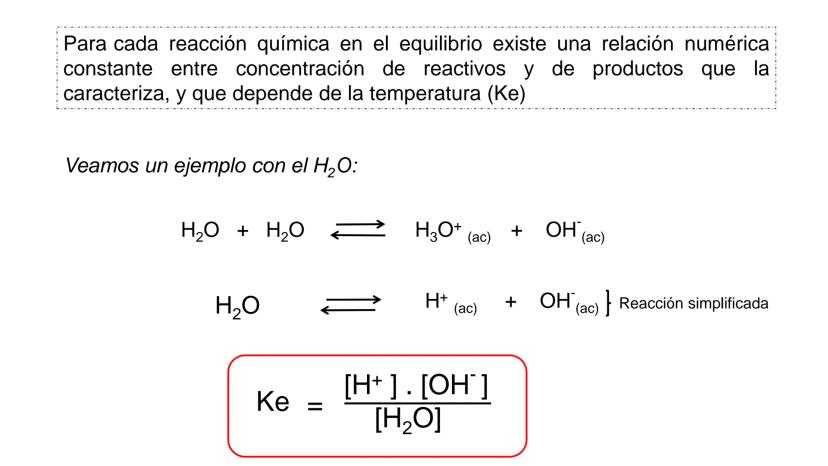
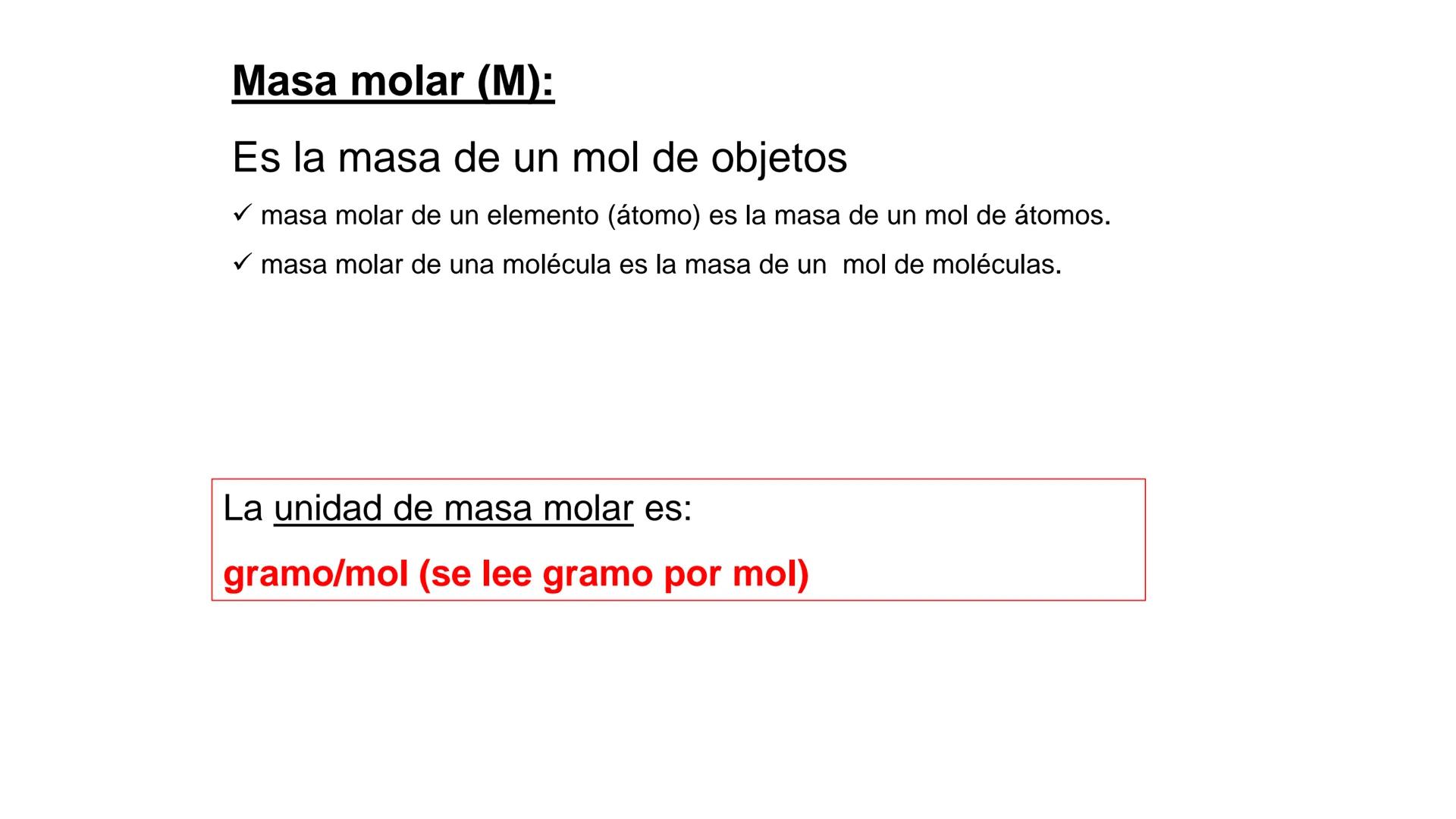
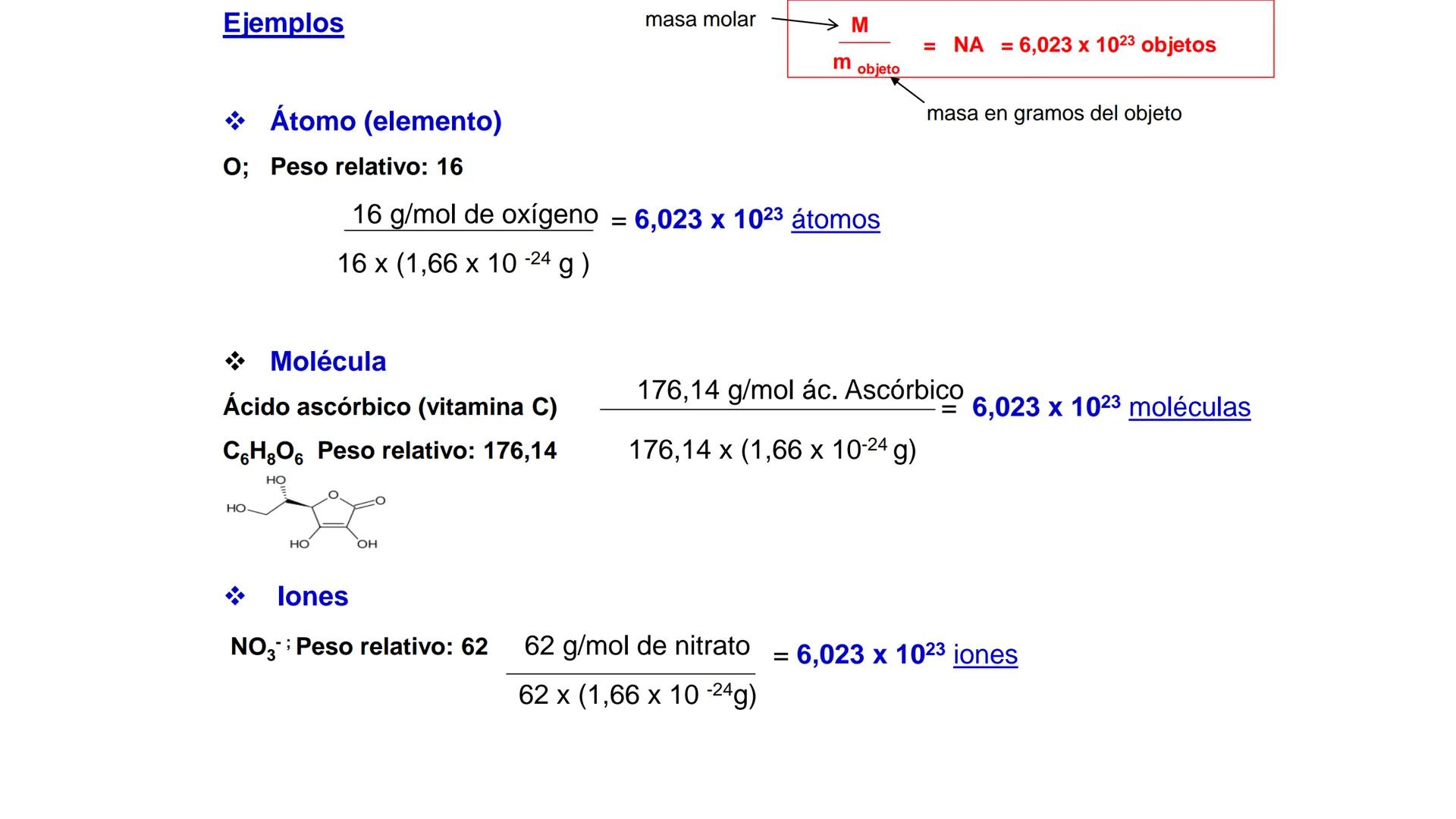
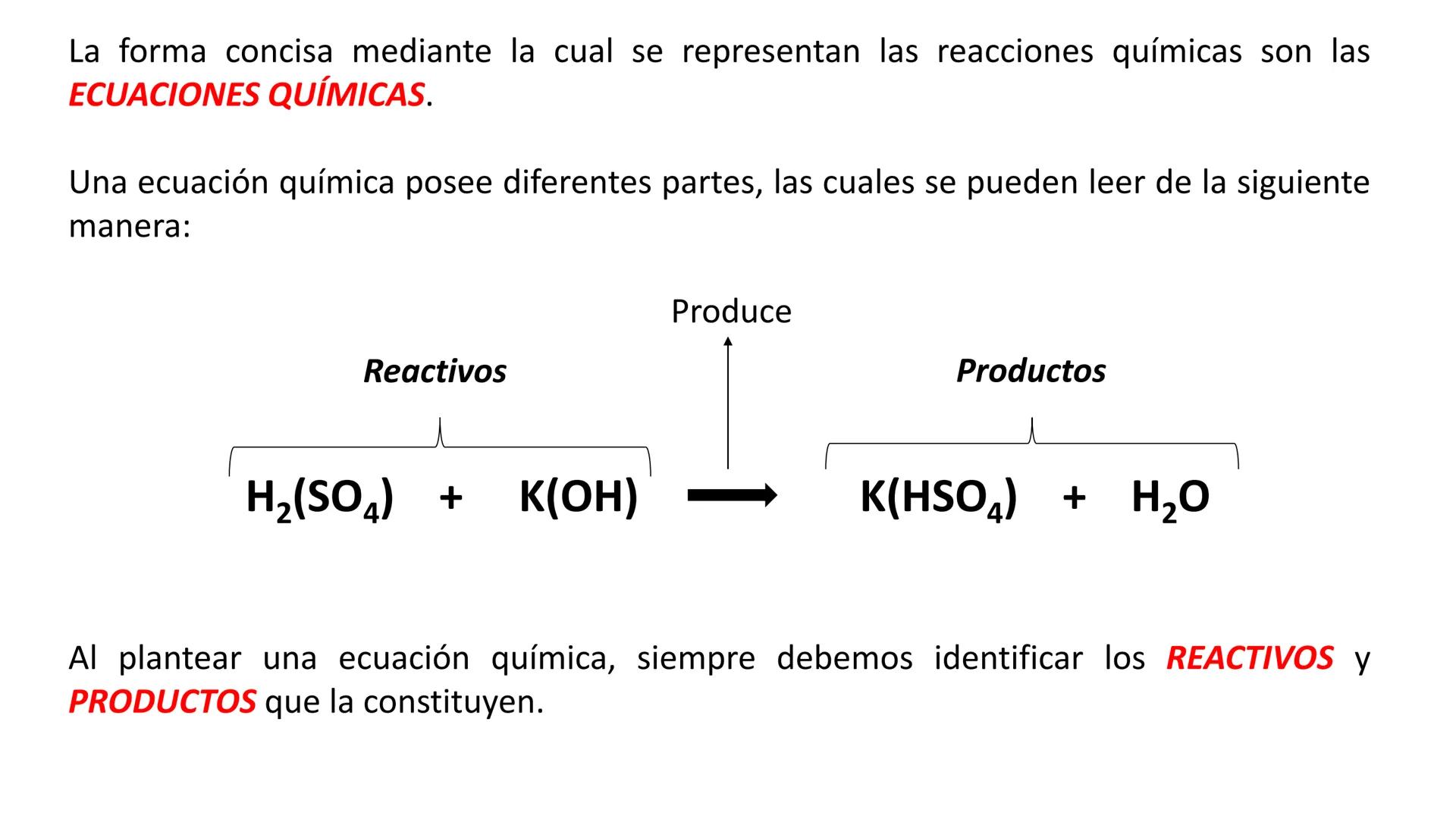
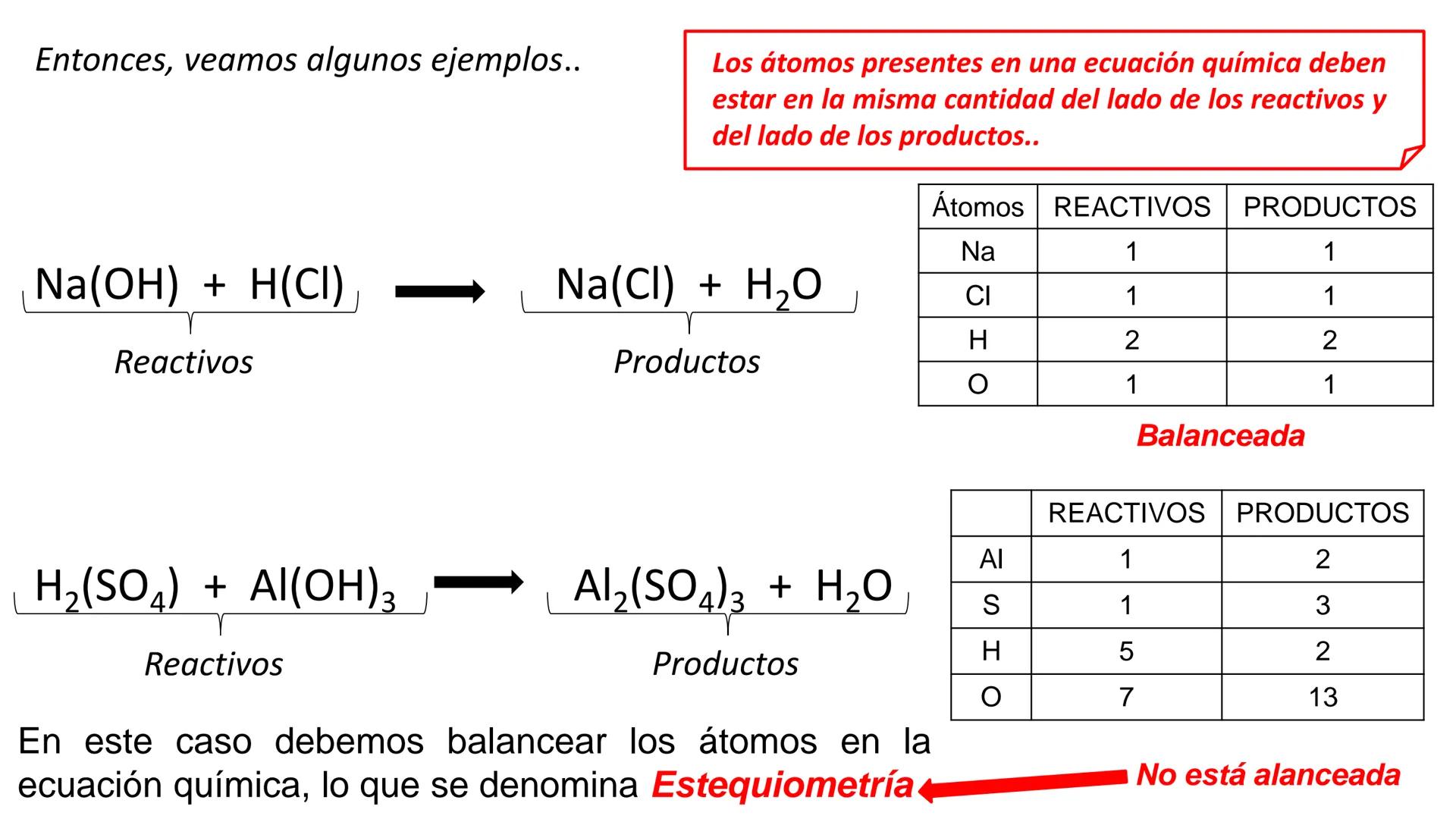
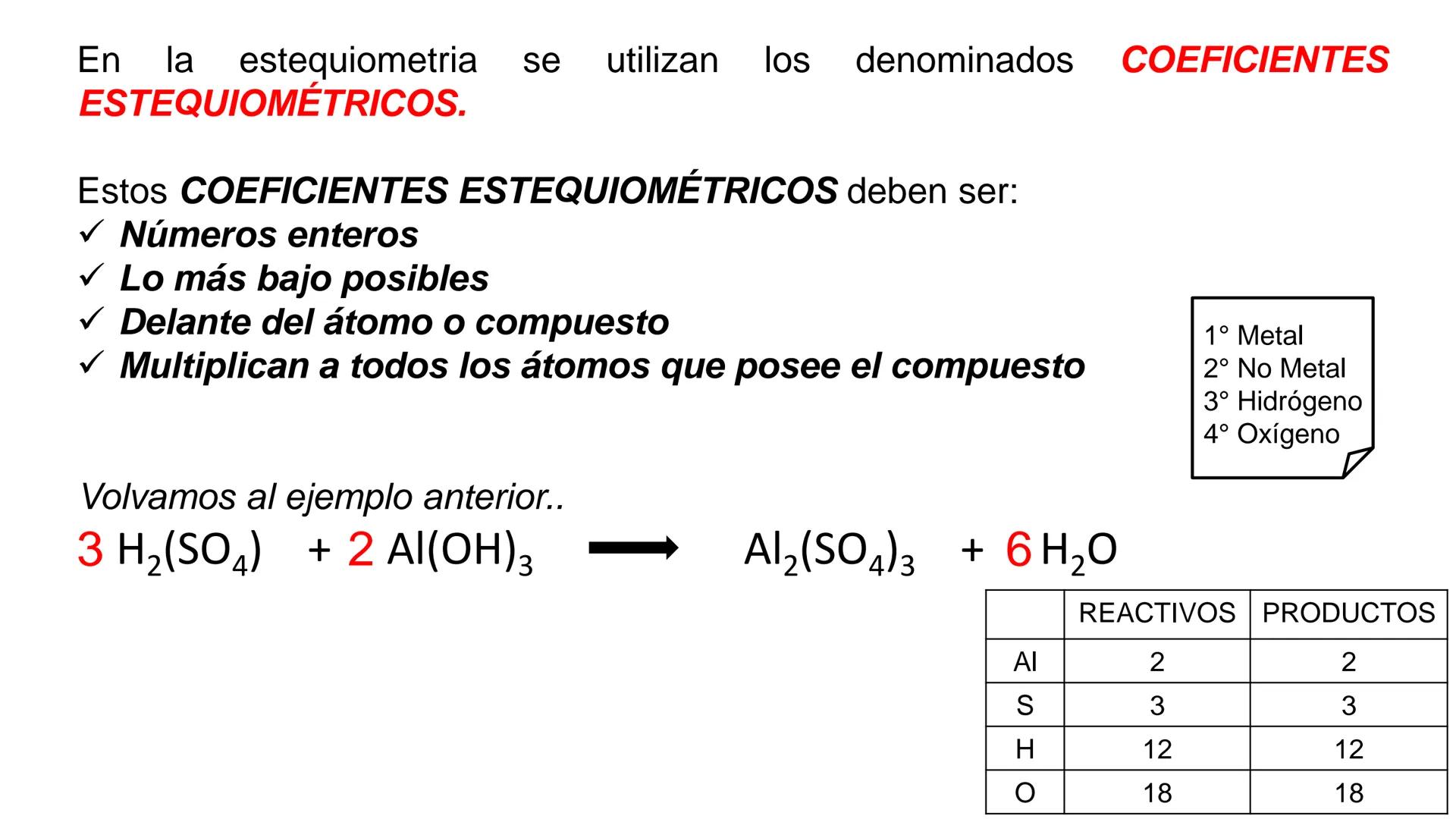
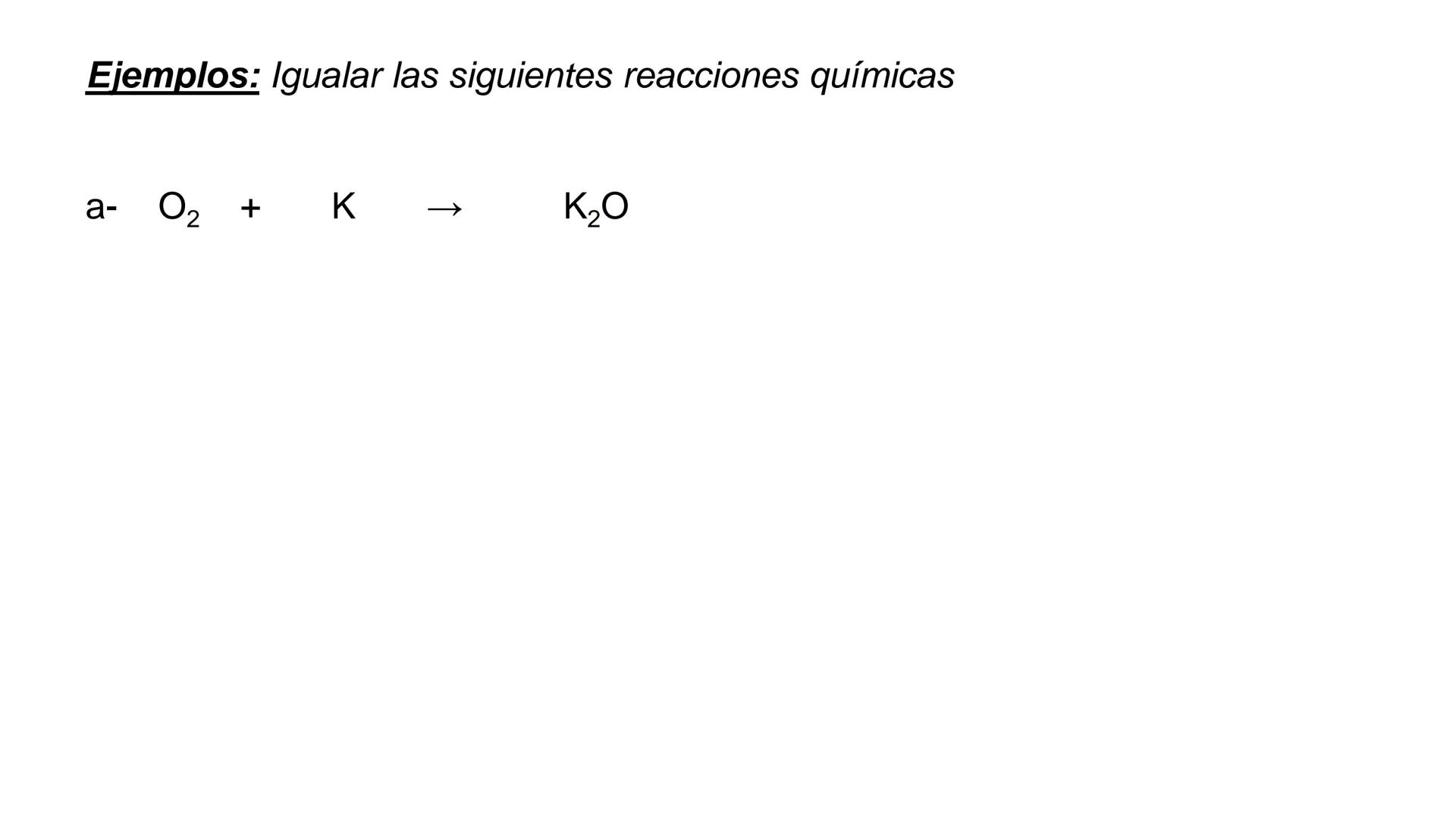
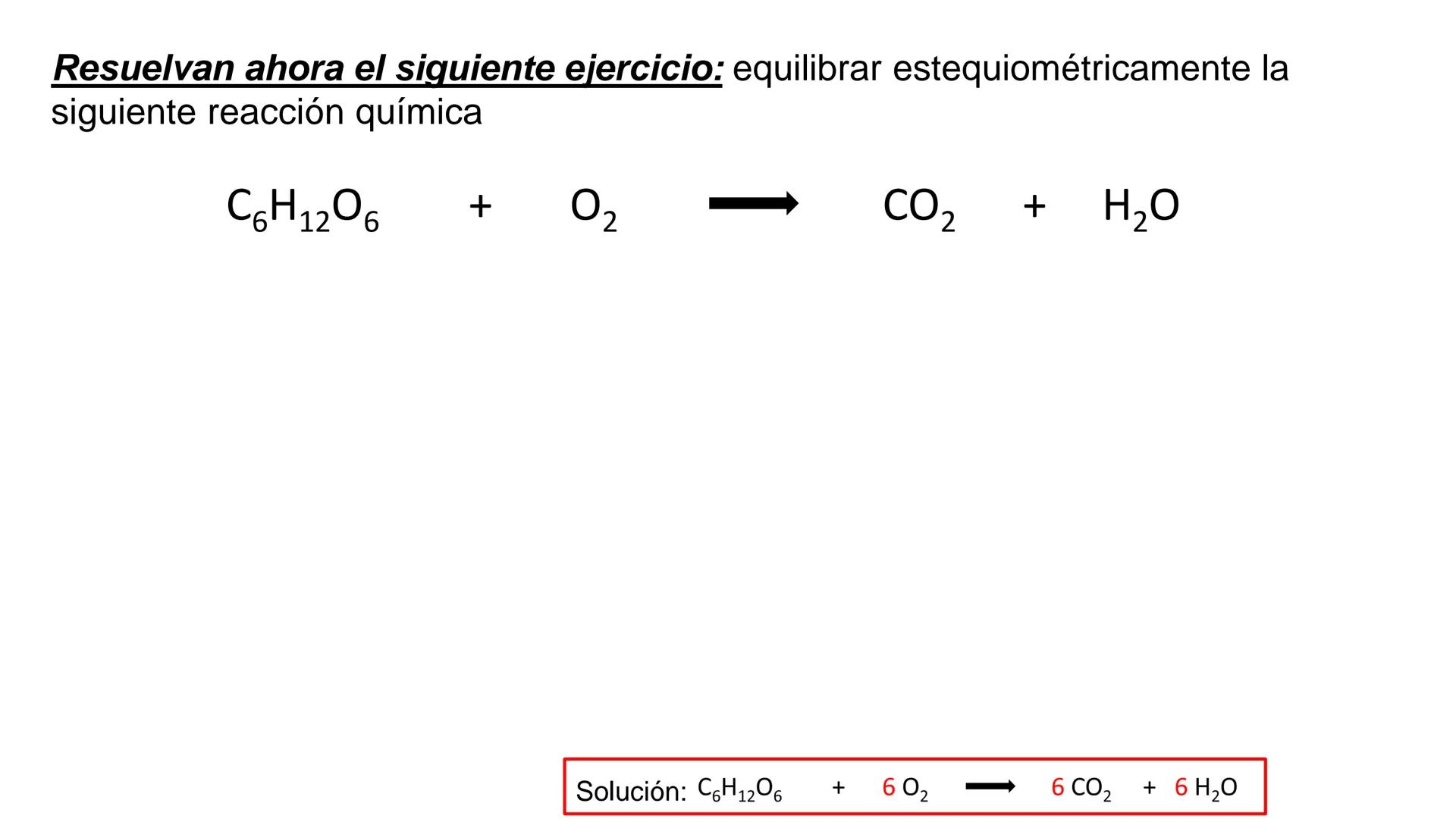
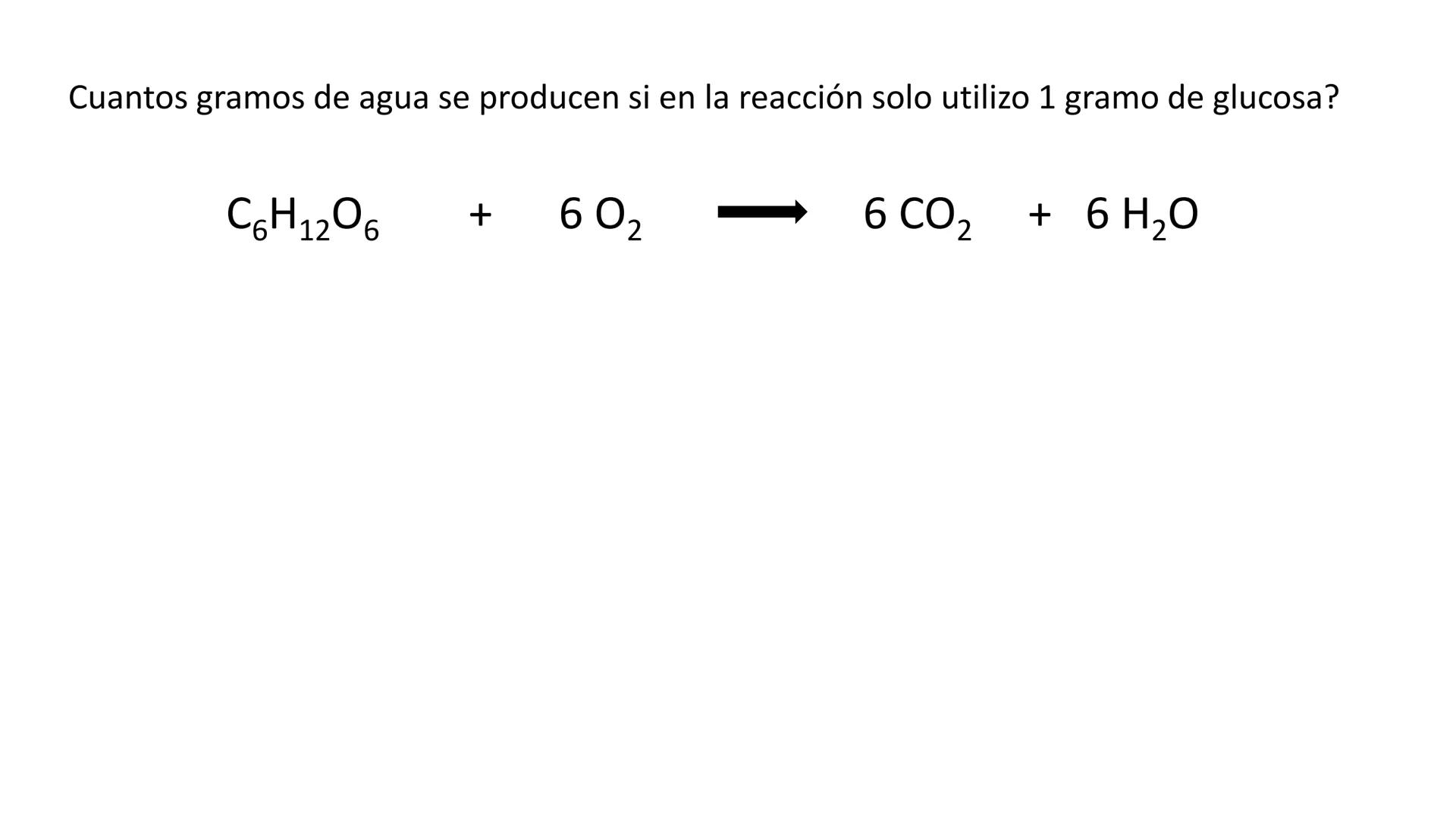
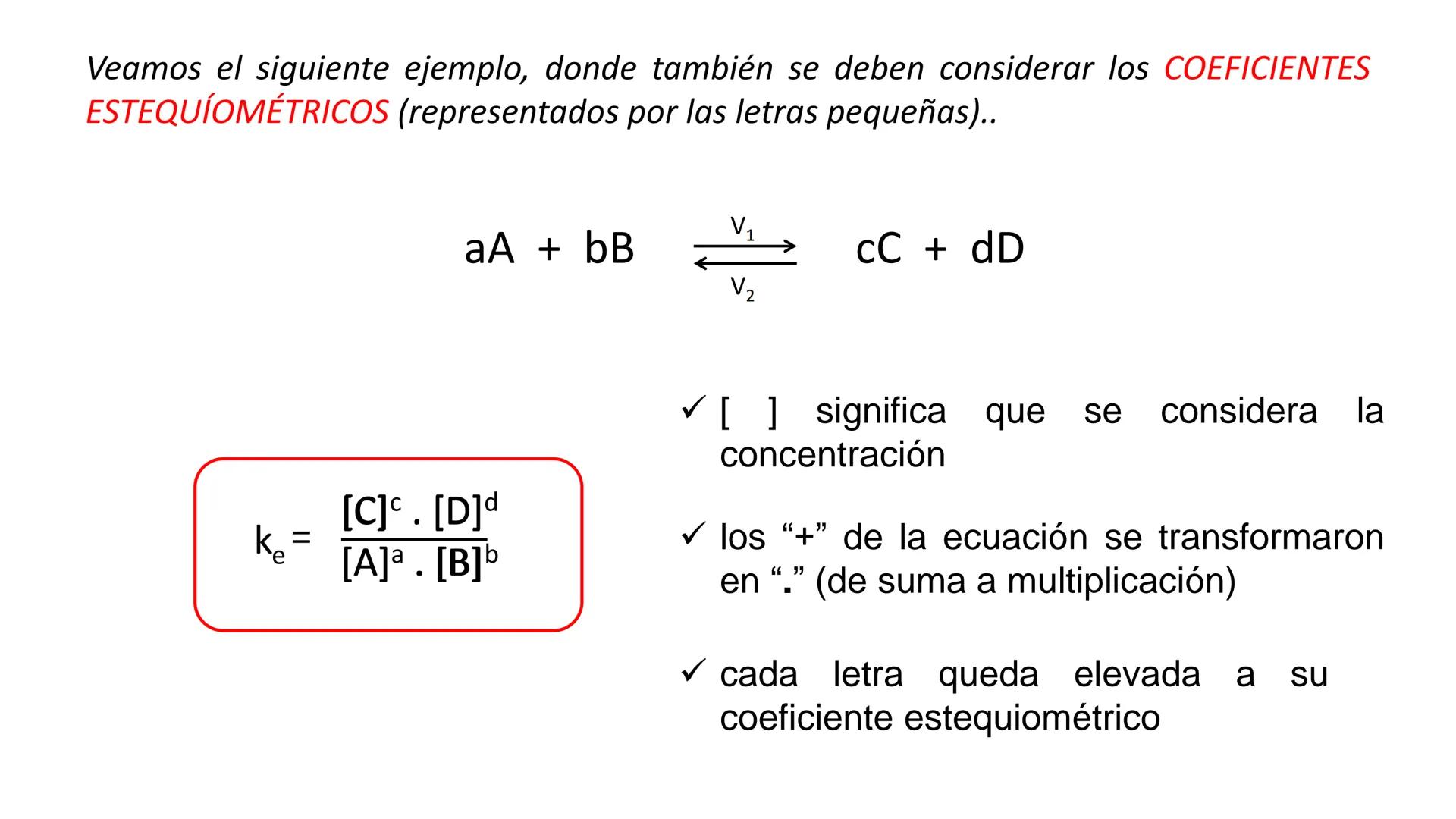
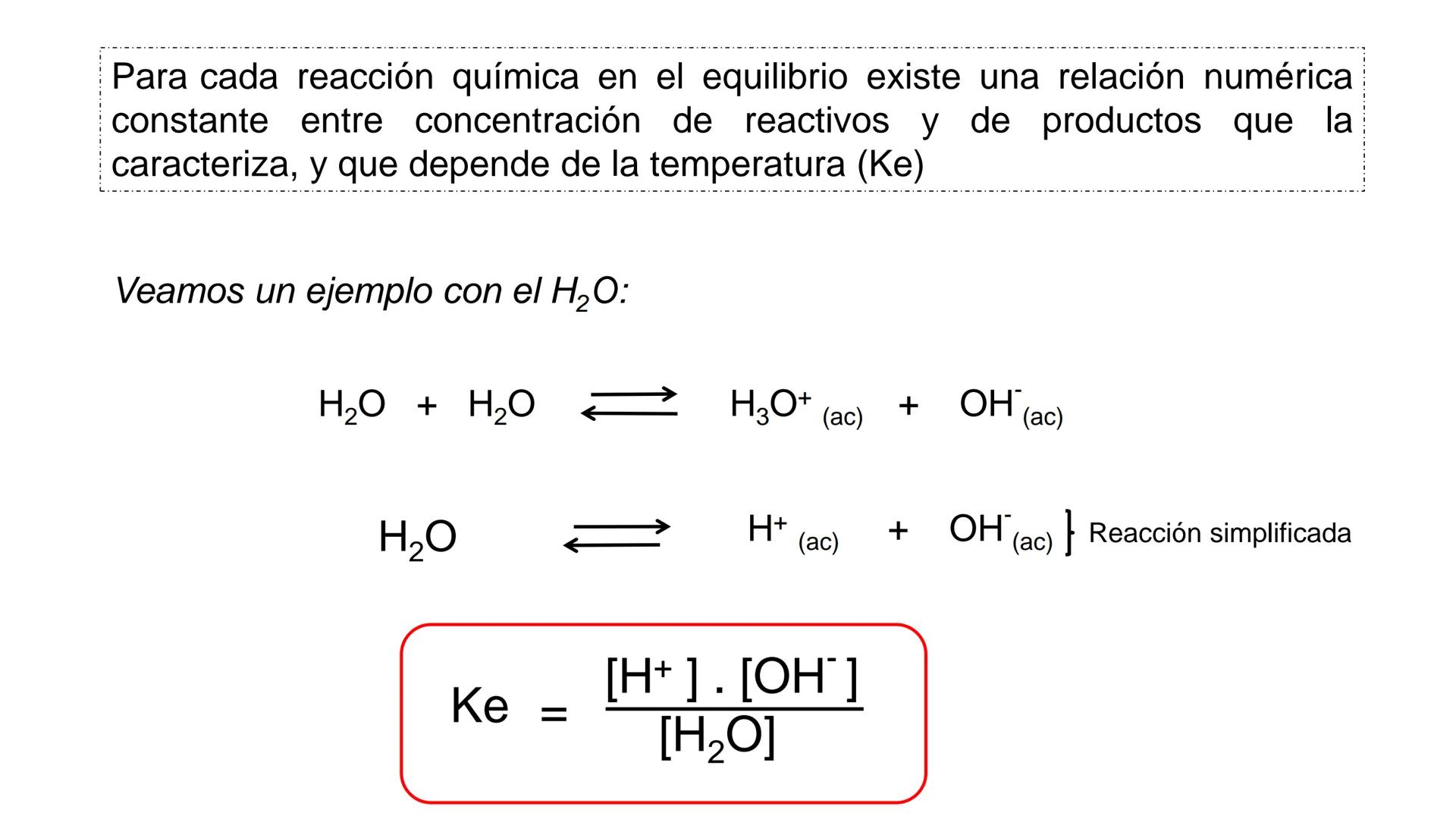
Conversión entre Masa en Gramos y Peso Relativo
Si conocemos el peso real de un átomo en gramos, podemos calcular su peso relativo en uma mediante una simple regla de tres:
Si el oxígeno (O) pesa $2,6568 \times 10^{-23}$ gramos:
$1,66054 \times 10^{-24}gramos−−−−−−−−1uma2,6568 \times 10^{-23}$ gramos -------- X
X = 1,66054×10−24 gramos2,6568×10−23 gramos×1 uma = 15,99 uma
Por lo tanto, el peso relativo del oxígeno es aproximadamente 16 uma.
Esta conversión es útil cuando trabajamos con datos experimentales y necesitamos pasar de mediciones reales a valores relativos.