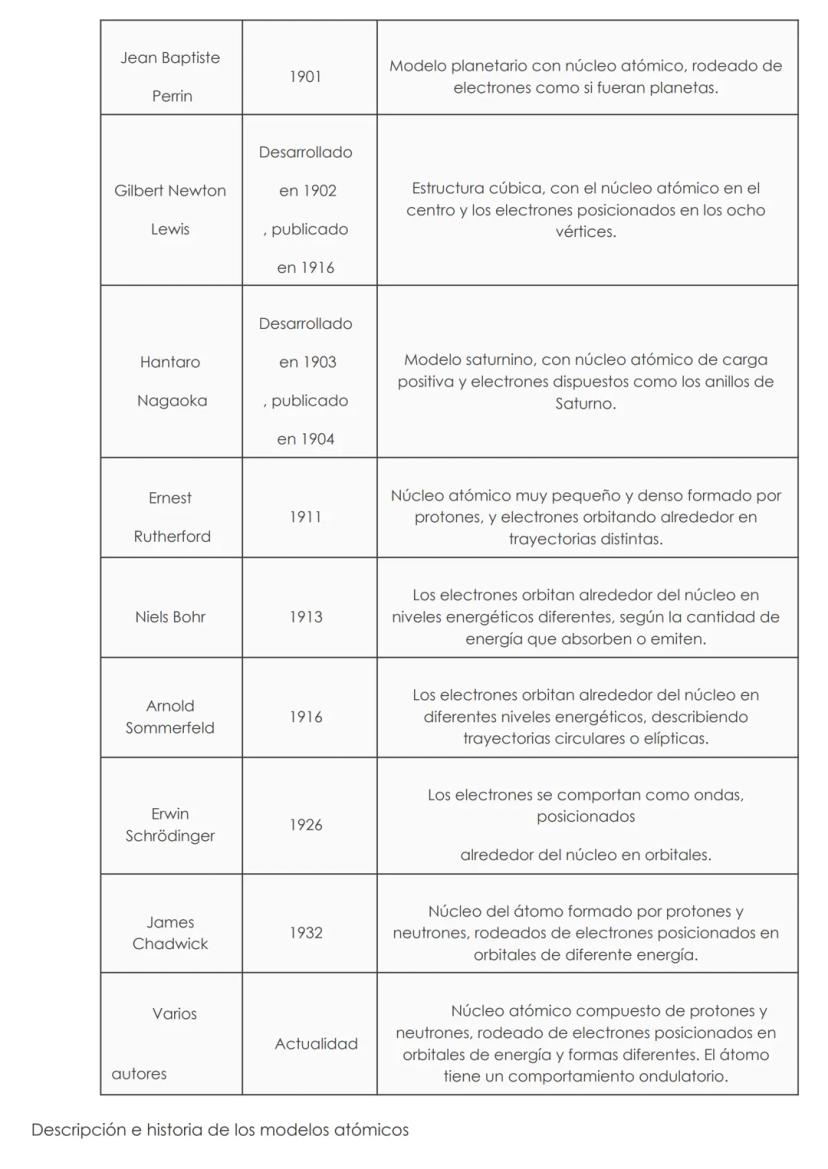
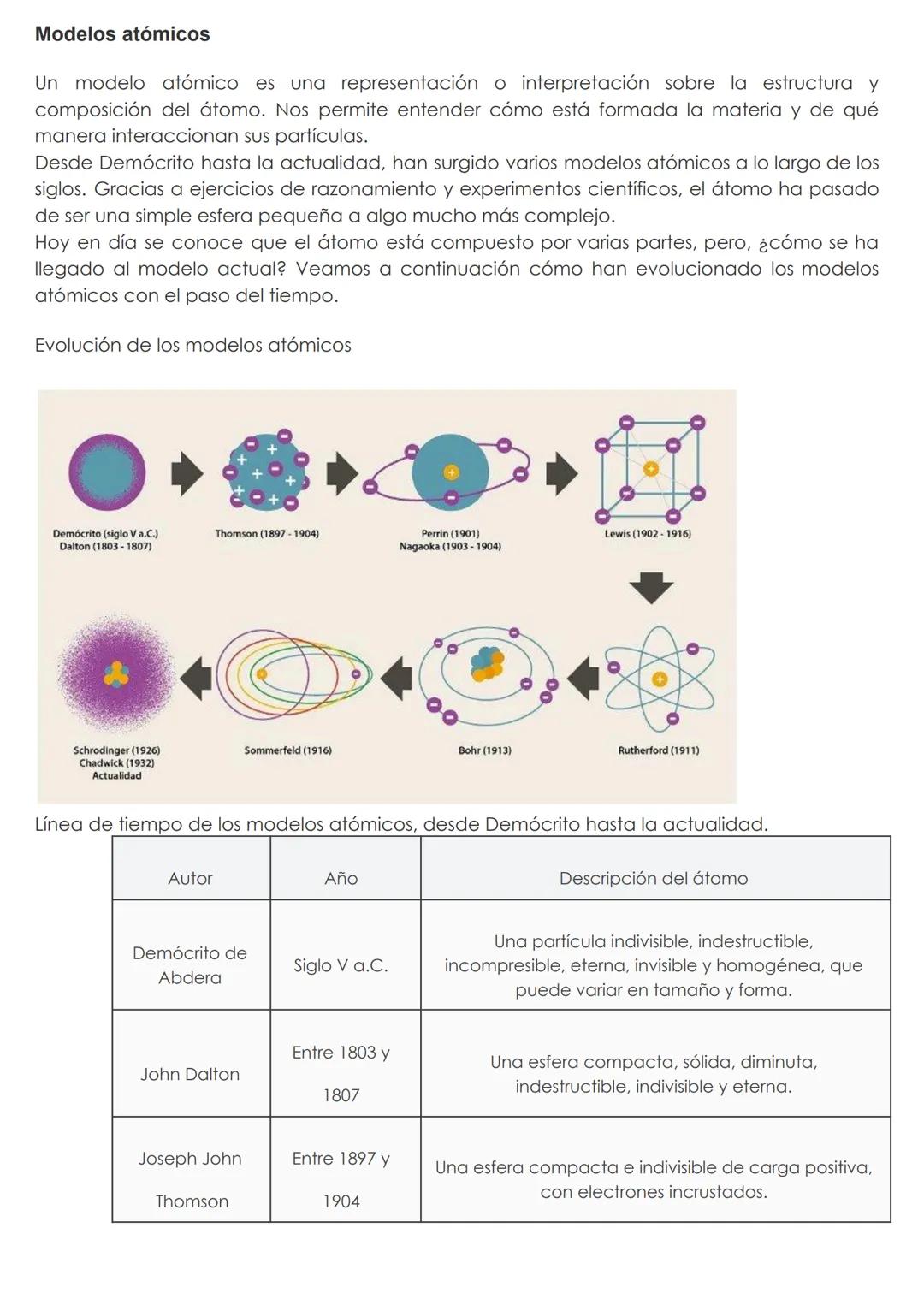
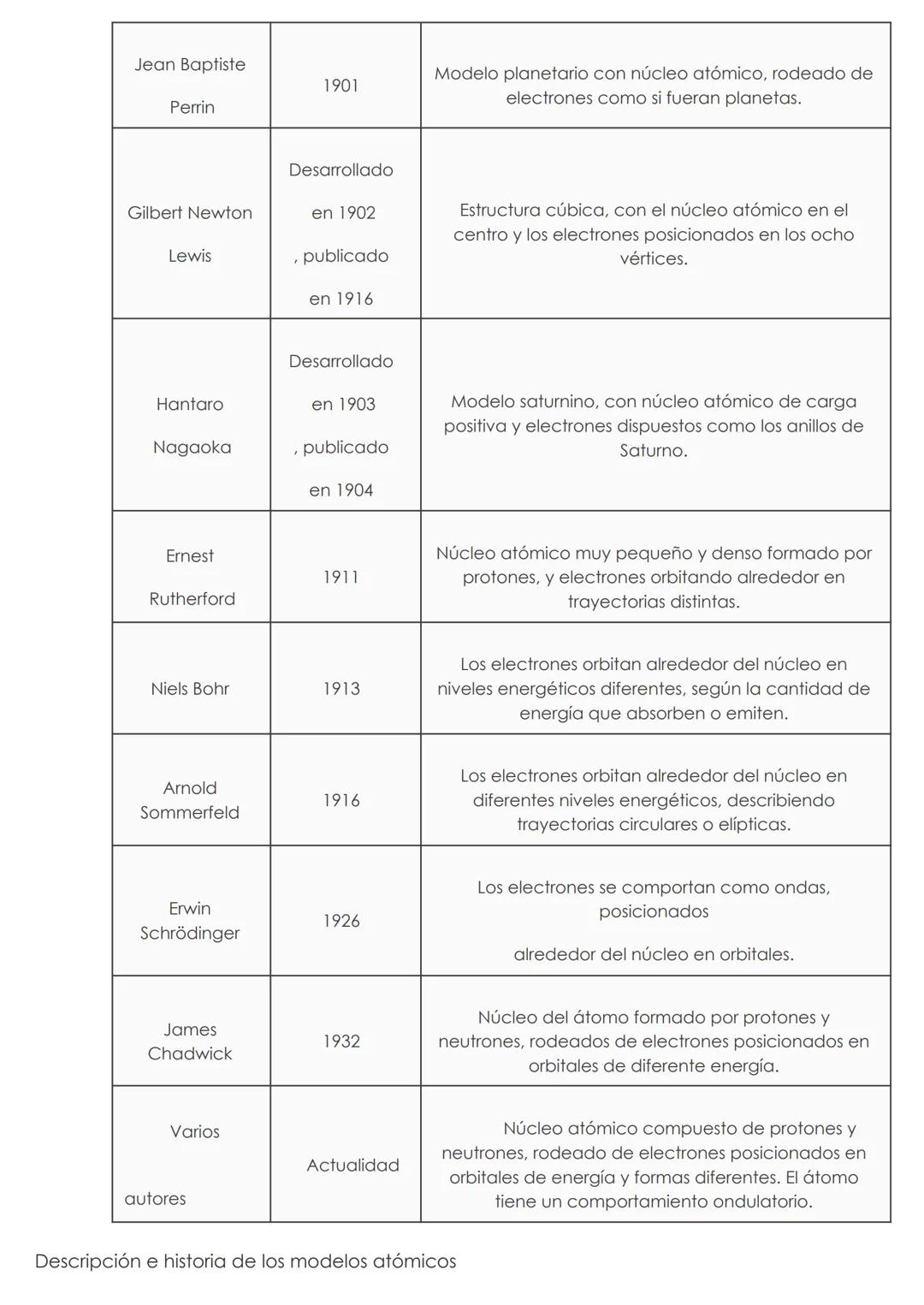
Evolución histórica de los modelos atómicos
La historia de los modelos atómicos muestra cómo el método científico funciona progresivamente, refinando teorías a medida que surgen nuevas evidencias experimentales. Cada científico construyó sobre los descubrimientos anteriores, creando una comprensión cada vez más precisa del átomo.
Los primeros modelos de Demócrito y Dalton concebían el átomo como una partícula indivisible. Thomson revolucionó esta idea al descubrir que el átomo contenía partículas más pequeñas (electrones). Rutherford demostró la existencia de un núcleo central, mientras que Bohr explicó cómo los electrones se organizan en niveles energéticos específicos.
La física cuántica transformó radicalmente nuestra comprensión con los trabajos de Sommerfeld, Schrödinger y otros. Se abandonó la idea de órbitas definidas en favor de nubes de probabilidad. El descubrimiento del neutrón por Chadwick completó la estructura básica del núcleo atómico.
Es importante reconocer que la mayoría de estos científicos fueron reconocidos con Premios Nobel por sus contribuciones: Thomson (1906), Rutherford (1908), Bohr (1922), Perrin (1926), Schrödinger (1933) y Chadwick (1935). Esto demuestra el impacto revolucionario que tuvieron estas ideas en la física y la química.
El modelo actual sigue evolucionando con nuevos descubrimientos en física de partículas, pero la estructura básica del átomo con su núcleo de protones y neutrones, rodeado por electrones en orbitales, permanece como la descripción fundamental de la materia.
💡 Cuando utilizamos tecnologías modernas como resonancias magnéticas, pantallas LED o células solares, estamos aprovechando directamente el conocimiento derivado de estos modelos atómicos. ¡La comprensión del átomo ha revolucionado prácticamente todos los aspectos de la tecnología moderna!