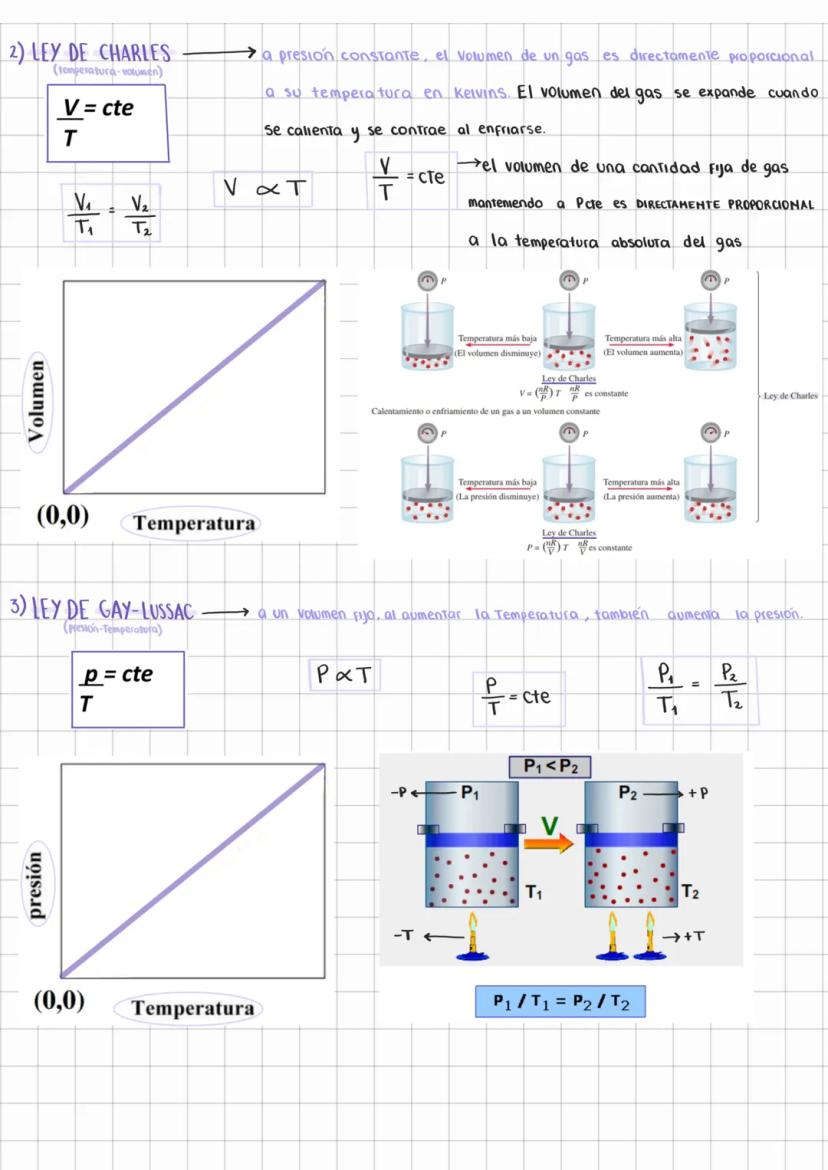
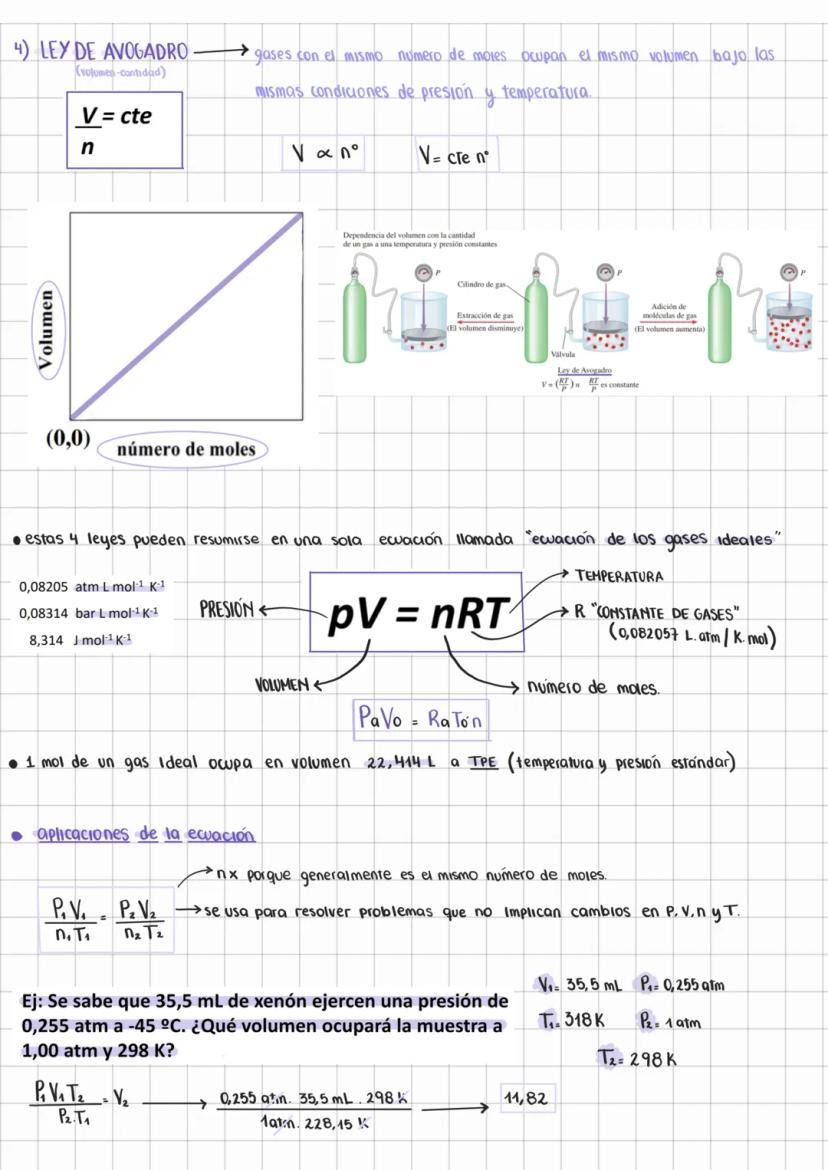
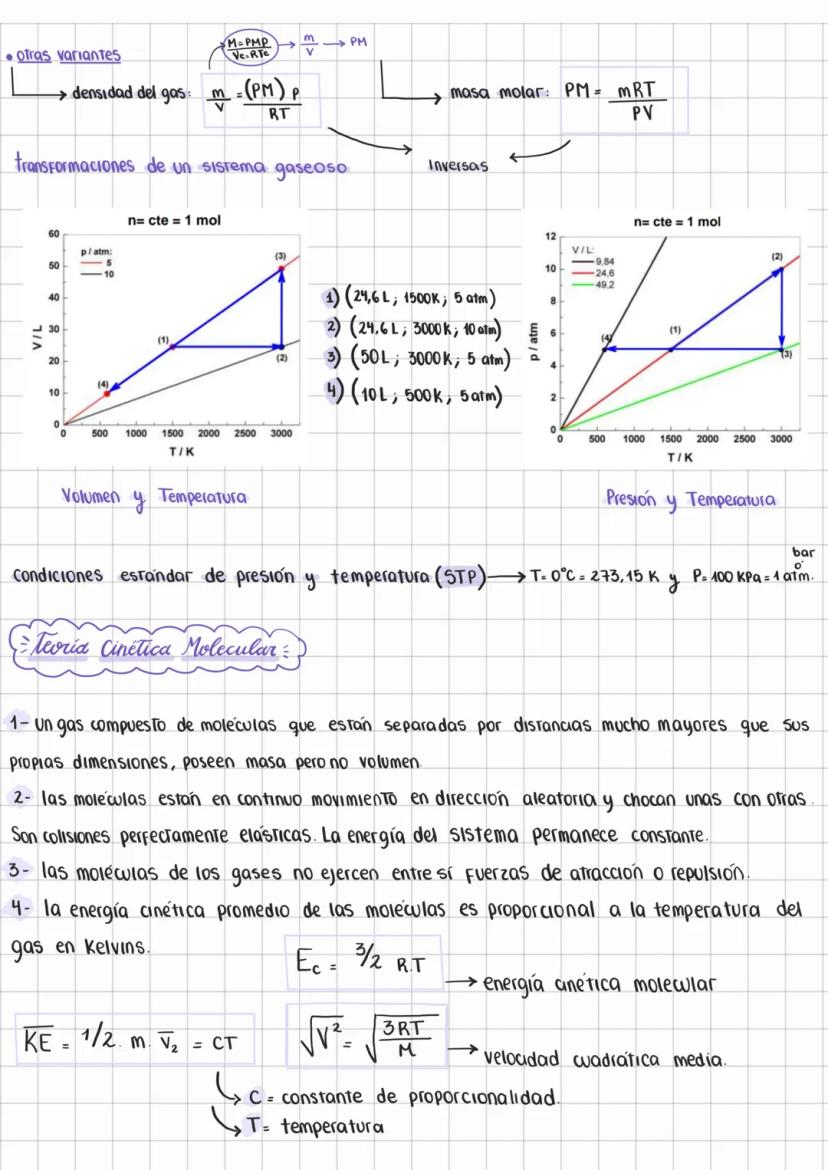
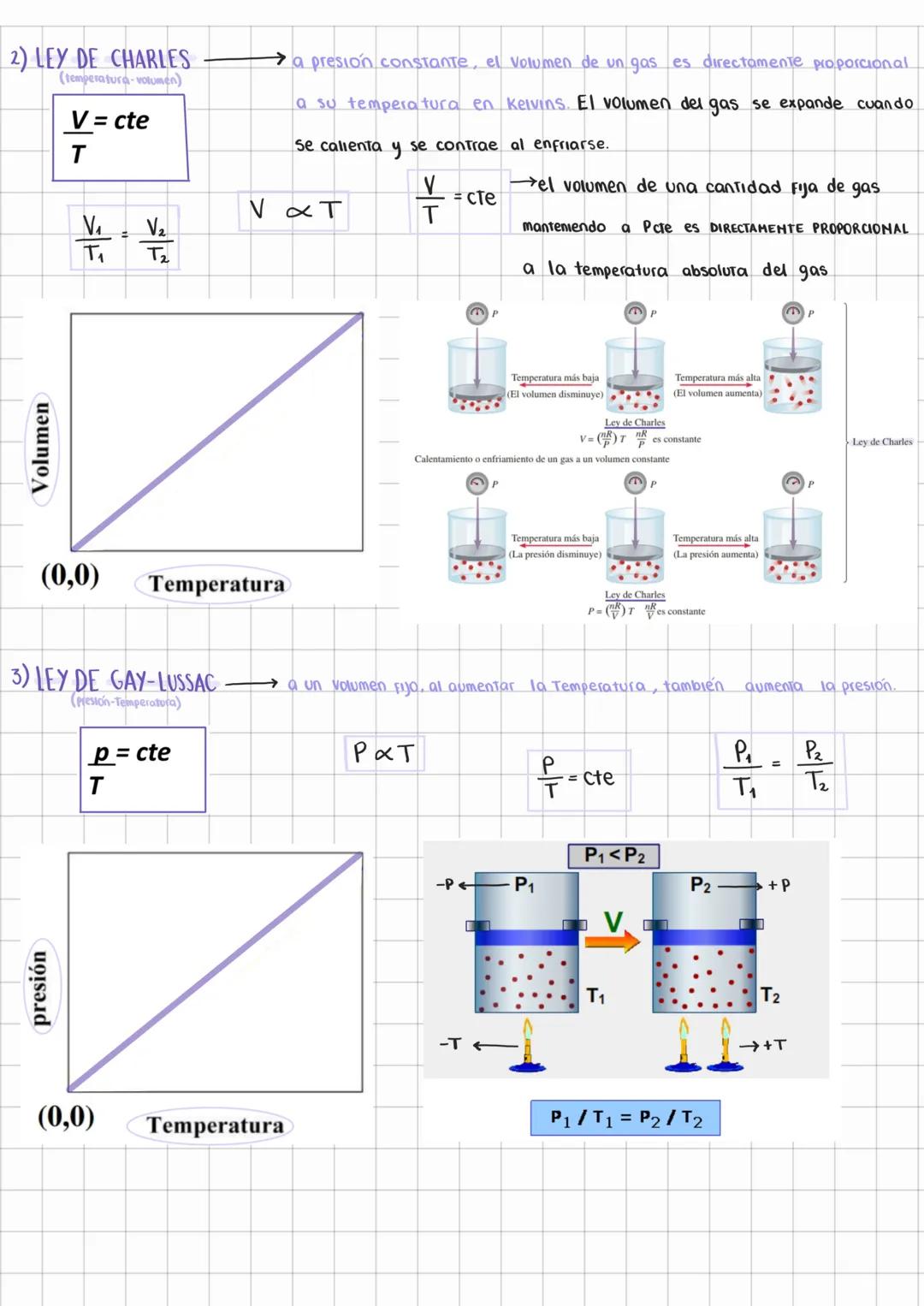
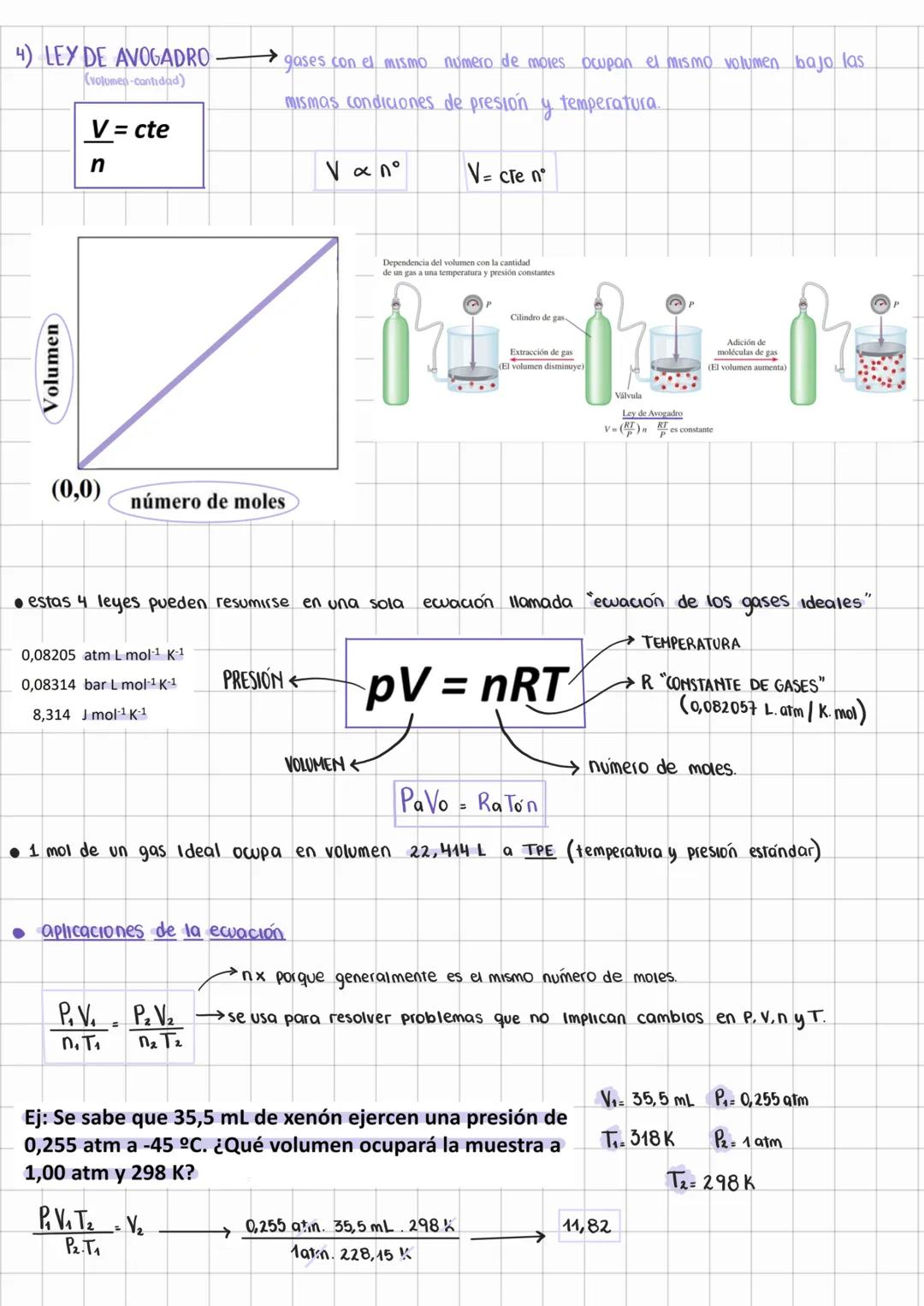
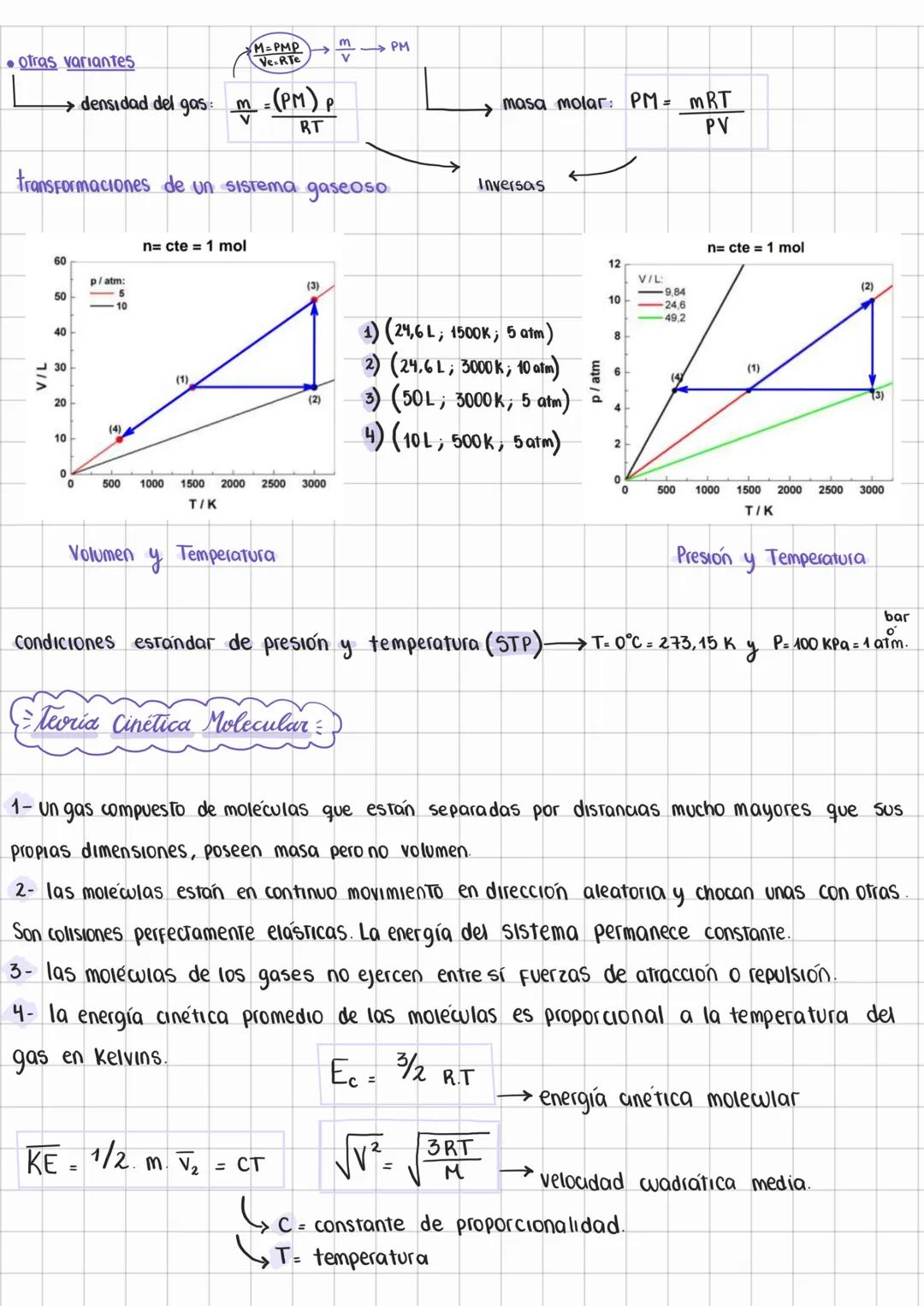
Características de los Gases y Presión
Los gases son los más rebeldes de todos los estados de la materia. Se adaptan completamente al recipiente que los contiene, son súper compresibles y se mezclan de forma perfecta cuando están juntos. Además, tienen densidades mucho menores que los sólidos y líquidos.
La presión de un gas es la fuerza que ejercen las moléculas cuando chocan constantemente contra las paredes del recipiente. Se calcula como Presión = Fuerza/Área y se mide en pascales (Pa).
La presión atmosférica es el peso de toda la atmósfera sobre nosotros. Cuanto más denso es el aire, mayor presión ejerce. Esta presión cambia según dónde estés, la temperatura y el clima, y se mide con un barómetro (la presión atmosférica estándar es 760 mmHg).
¡Dato curioso! La presión atmosférica es como tener un elefante parado sobre cada metro cuadrado de tu cuerpo, pero no lo sentís porque tu cuerpo está diseñado para equilibrarla.
Ley de Boyle: Presión vs Volumen
La Ley de Boyle te dice algo súper lógico: si apretás un gas (aumentás la presión), ocupa menos espacio (disminuye el volumen). Es como apretar una esponja: mientras más fuerza hacés, más se achica.
La fórmula es PV = constante, lo que significa que presión y volumen son inversamente proporcionales. Si duplicás la presión, el volumen se reduce a la mitad. Esto solo funciona cuando la temperatura se mantiene constante.
Esta ley explica por qué podés comprimir el aire en una jeringa o por qué los buzos necesitan cuidarse de la presión cuando suben a la superficie.