Del Modelo de Bohr a los Orbitales Modernos
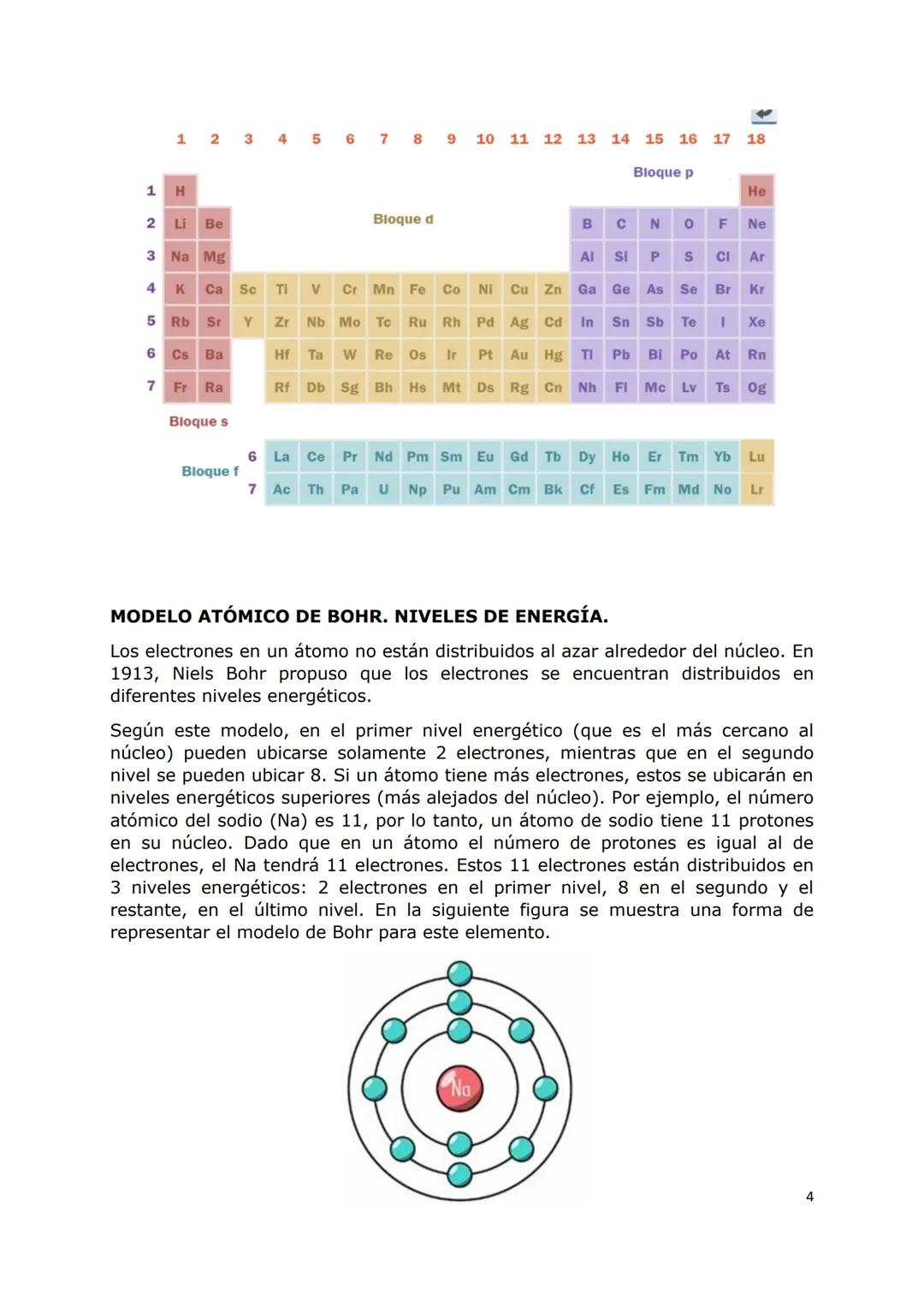
El modelo atómico de Bohr fue revolucionario porque explicó por qué los elementos absorben y emiten luz de colores específicos. Imaginá los electrones como planetas girando en órbitas fijas alrededor del núcleo, donde cada órbita tiene una energía determinada.
Cuando un electrón absorbe energía, "salta" a una órbita más alejada del núcleo. Cuando vuelve a bajar, emite esa energía como luz, creando esos colores únicos que vemos en los fuegos artificiales.
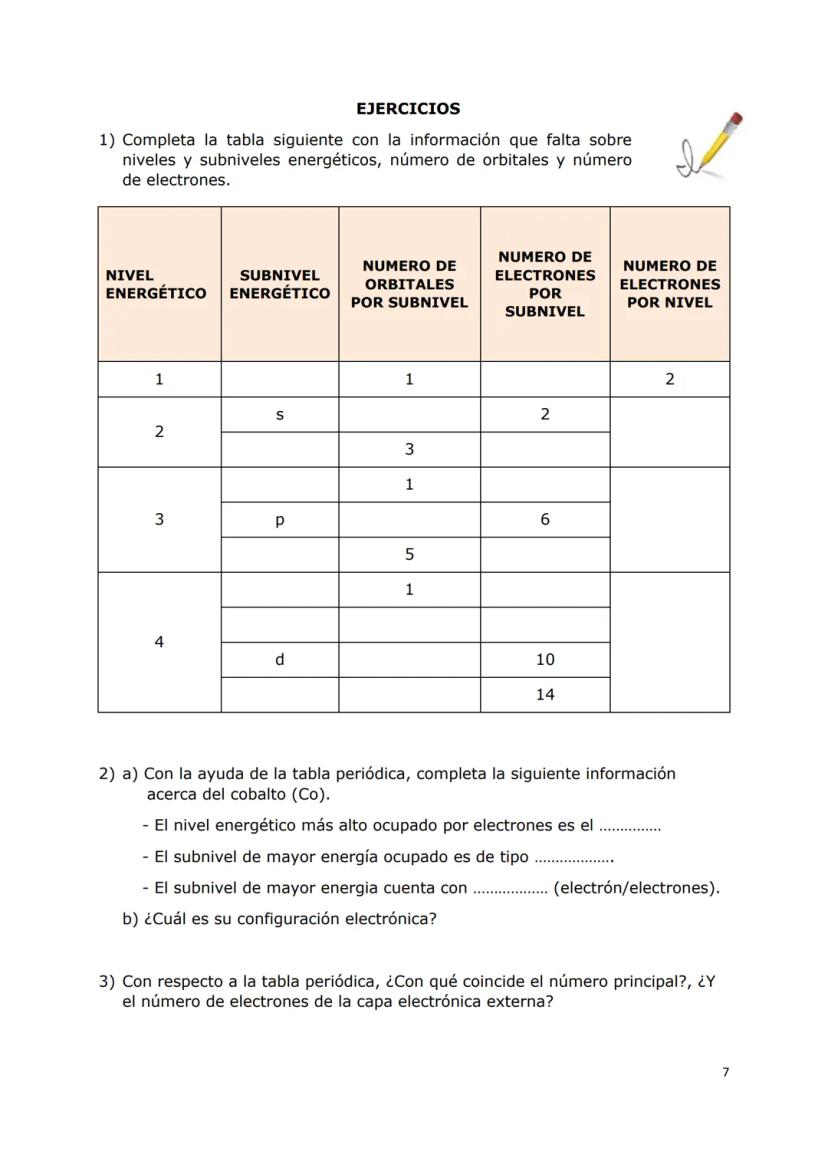
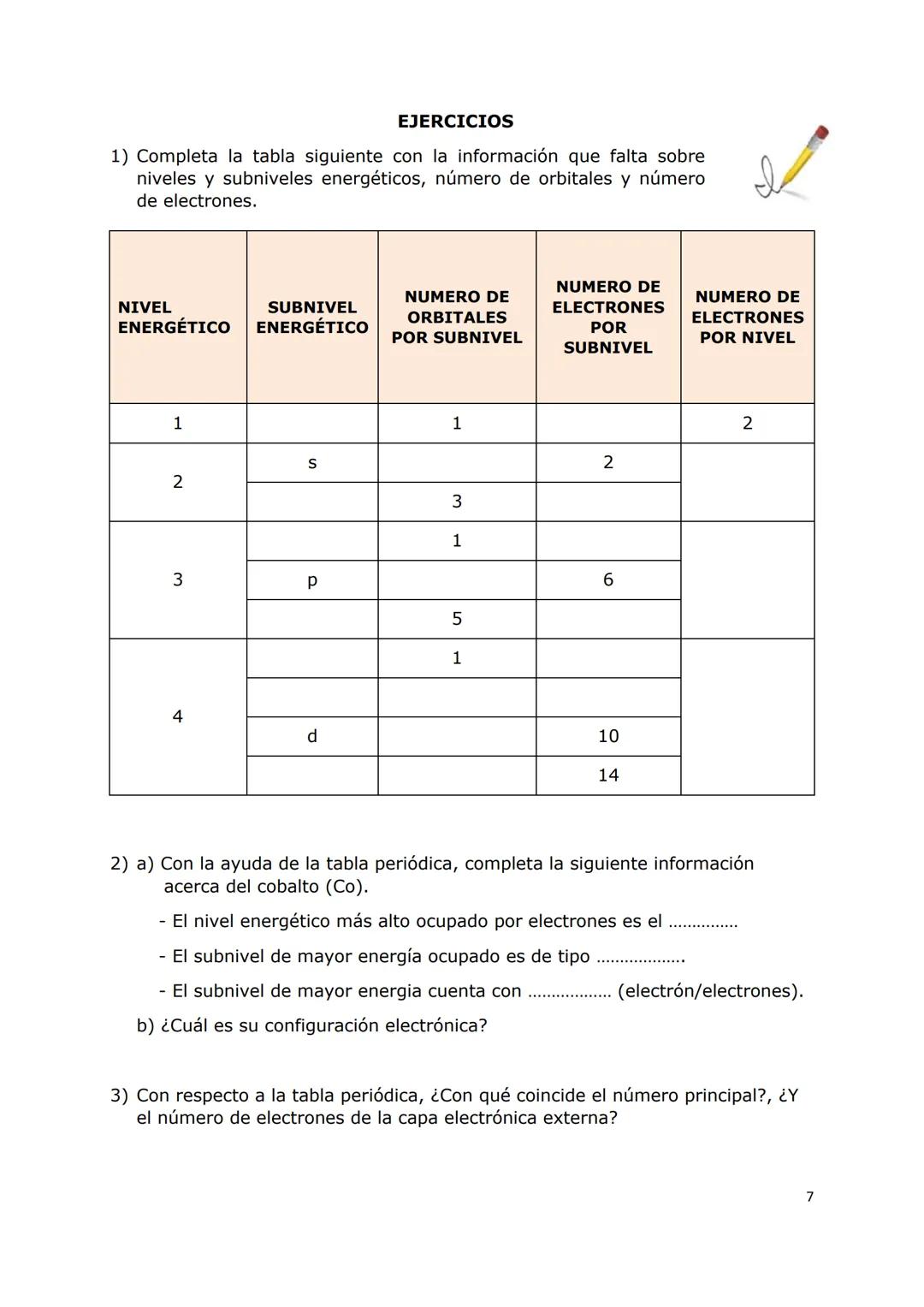
El modelo actual es más sofisticado: en lugar de órbitas circulares, tenemos orbitales atómicos - regiones tridimensionales donde es más probable encontrar electrones. Existen cuatro tipos principales: s, p, d y f, cada uno con formas y características únicas.
Dato clave: Cada orbital puede contener máximo 2 electrones, sin importar su tipo.